+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2n87 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
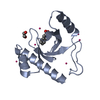
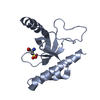
| タイトル | Solution structure of the PPIase domain of TbPar42 | |||||||||
 要素 要素 | Uncharacterized protein | |||||||||
 キーワード キーワード | ISOMERASE / PPIase domain / Parvulin | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 溶液NMR / torsion angle dynamics, simulated annealing, molecular dynamics | |||||||||
| Model details | lowest energy, model1 | |||||||||
 データ登録者 データ登録者 | Rehic, E. / Bayer, P. | |||||||||
 引用 引用 |  ジャーナル: Biomolecules / 年: 2019 ジャーナル: Biomolecules / 年: 2019タイトル: Structural Analysis of the 42 kDa Parvulin of Trypanosoma brucei. 著者: Rehic, E. / Hoenig, D. / Kamba, B.E. / Goehring, A. / Hofmann, E. / Gasper, R. / Matena, A. / Bayer, P. #1: ジャーナル: Febs Lett. / 年: 2010 タイトル: Functional characterization of two novel parvulins in Trypanosoma brucei. 著者: Goh, J.Y. / Lai, C.Y. / Tan, L.C. / Yang, D. / He, C.Y. / Liou, Y.C. #2: ジャーナル: Biochim.Biophys.Acta / 年: 2010 タイトル: Identification of an atypical peptidyl-prolyl cis/trans isomerase from trypanosomatids. 著者: Erben, E.D. / Valguarnera, E. / Nardelli, S. / Chung, J. / Daum, S. / Potenza, M. / Schenkman, S. / Tellez-Inon, M.T. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2n87.cif.gz 2n87.cif.gz | 431.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2n87.ent.gz pdb2n87.ent.gz | 366.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2n87.json.gz 2n87.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2n87_validation.pdf.gz 2n87_validation.pdf.gz | 398.3 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2n87_full_validation.pdf.gz 2n87_full_validation.pdf.gz | 466.1 KB | 表示 | |
| XML形式データ |  2n87_validation.xml.gz 2n87_validation.xml.gz | 21.8 KB | 表示 | |
| CIF形式データ |  2n87_validation.cif.gz 2n87_validation.cif.gz | 33.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/n8/2n87 https://data.pdbj.org/pub/pdb/validation_reports/n8/2n87 ftp://data.pdbj.org/pub/pdb/validation_reports/n8/2n87 ftp://data.pdbj.org/pub/pdb/validation_reports/n8/2n87 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 13522.224 Da / 分子数: 1 / 断片: residues 264-383 / 由来タイプ: 組換発現 由来: (組換発現)  株: 927/4 GUTat10.1 / 遺伝子: Tb927.7.2480 / 発現宿主:  |
|---|
-実験情報
-実験
| 実験 | 手法: 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 試料状態 | pH: 6.26 / 温度: 300 K |
-NMR測定
| NMRスペクトロメーター | タイプ: Bruker Avance Ultrashield / 製造業者: Bruker / モデル: Avance Ultrashield / 磁場強度: 700 MHz |
|---|
- 解析
解析
| NMR software |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: torsion angle dynamics, simulated annealing, molecular dynamics ソフトェア番号: 1 | ||||||||||||||||||||||||||||||||||||||||
| NMR constraints | NOE constraints total: 2268 / NOE intraresidue total count: 455 / NOE long range total count: 802 / NOE medium range total count: 443 / NOE sequential total count: 568 / Hydrogen bond constraints total count: 185 / Protein phi angle constraints total count: 103 / Protein psi angle constraints total count: 103 | ||||||||||||||||||||||||||||||||||||||||
| 代表構造 | 選択基準: lowest energy | ||||||||||||||||||||||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: structures with the lowest energy 計算したコンフォーマーの数: 60 / 登録したコンフォーマーの数: 10 |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj

 HSQC
HSQC