| 登録情報 | データベース: PDB / ID: 2mdj
|
|---|
| タイトル | Solution structure of WW domain with polyproline stretch (PP2WW) of HYPB |
|---|
 要素 要素 | Histone-lysine N-methyltransferase SETD2 |
|---|
 キーワード キーワード | TRANSFERASE / WW domain / HYPB / polyproline |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
mesoderm morphogenesis / morphogenesis of a branching structure / peptidyl-lysine trimethylation / coronary vasculature morphogenesis / cell migration involved in vasculogenesis / microtubule cytoskeleton organization involved in mitosis / [histone H3]-lysine36 N-trimethyltransferase / embryonic placenta morphogenesis / histone H3K36 trimethyltransferase activity / pericardium development ...mesoderm morphogenesis / morphogenesis of a branching structure / peptidyl-lysine trimethylation / coronary vasculature morphogenesis / cell migration involved in vasculogenesis / microtubule cytoskeleton organization involved in mitosis / [histone H3]-lysine36 N-trimethyltransferase / embryonic placenta morphogenesis / histone H3K36 trimethyltransferase activity / pericardium development / regulation of mRNA export from nucleus / stem cell development / histone H3K36 methyltransferase activity / nucleosome organization / response to type I interferon / protein-lysine N-methyltransferase activity / embryonic cranial skeleton morphogenesis / positive regulation of ossification / response to alkaloid / regulation of protein localization to chromatin / response to metal ion / histone H3 methyltransferase activity / regulation of double-strand break repair via homologous recombination / endodermal cell differentiation / positive regulation of interferon-alpha production / alpha-tubulin binding / mismatch repair / forebrain development / positive regulation of autophagy / 転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの / regulation of cytokinesis / stem cell differentiation / neural tube closure / transcription elongation by RNA polymerase II / : / PKMTs methylate histone lysines / chromosome / regulation of gene expression / angiogenesis / defense response to virus / regulation of DNA-templated transcription / nucleoplasm / metal ion binding / nucleus / cytoplasm類似検索 - 分子機能 Histone-lysine N-methyltransferase SETD2, animal / Set2 Rpb1 interacting domain superfamily / SETD2/Set2, SET domain / Set2 Rpb1 interacting domain / SRI (Set2 Rpb1 interacting) domain / AWS domain / AWS domain / AWS domain profile. / associated with SET domains / Cysteine-rich motif following a subset of SET domains ...Histone-lysine N-methyltransferase SETD2, animal / Set2 Rpb1 interacting domain superfamily / SETD2/Set2, SET domain / Set2 Rpb1 interacting domain / SRI (Set2 Rpb1 interacting) domain / AWS domain / AWS domain / AWS domain profile. / associated with SET domains / Cysteine-rich motif following a subset of SET domains / TFIIS/LEDGF domain superfamily / Post-SET domain / Post-SET domain profile. / WW domain / WW/rsp5/WWP domain signature. / WW domain superfamily / WW/rsp5/WWP domain profile. / Domain with 2 conserved Trp (W) residues / SET (Su(var)3-9, Enhancer-of-zeste, Trithorax) domain / WW domain / SET domain / SET domain superfamily / SET domain profile. / SET domain類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 | 溶液NMR / simulated annealing |
|---|
| Model details | closest to the average, model1 |
|---|
 データ登録者 データ登録者 | Gao, Y. / Hu, H. |
|---|
 引用 引用 |  ジャーナル: Structure / 年: 2014 ジャーナル: Structure / 年: 2014
タイトル: Autoinhibitory structure of the WW domain of HYPB/SETD2 regulates its interaction with the proline-rich region of huntingtin
著者: Gao, Y.G. / Yang, H. / Zhao, J. / Jiang, Y.J. / Hu, H.Y. |
|---|
| 履歴 | | 登録 | 2013年9月11日 | 登録サイト: BMRB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2014年9月10日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2023年6月14日 | Group: Data collection / Database references / Other
カテゴリ: database_2 / pdbx_database_status ...database_2 / pdbx_database_status / pdbx_nmr_software / pdbx_nmr_spectrometer / struct_ref_seq_dif
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_nmr_data / _pdbx_nmr_software.name / _pdbx_nmr_spectrometer.model / _struct_ref_seq_dif.details |
|---|
| 改定 1.2 | 2024年5月15日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2 / Item: _database_2.pdbx_DOI |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2014
ジャーナル: Structure / 年: 2014 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2mdj.cif.gz
2mdj.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2mdj.ent.gz
pdb2mdj.ent.gz PDB形式
PDB形式 2mdj.json.gz
2mdj.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2mdj_validation.pdf.gz
2mdj_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2mdj_full_validation.pdf.gz
2mdj_full_validation.pdf.gz 2mdj_validation.xml.gz
2mdj_validation.xml.gz 2mdj_validation.cif.gz
2mdj_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/md/2mdj
https://data.pdbj.org/pub/pdb/validation_reports/md/2mdj ftp://data.pdbj.org/pub/pdb/validation_reports/md/2mdj
ftp://data.pdbj.org/pub/pdb/validation_reports/md/2mdj リンク
リンク 集合体
集合体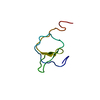
 要素
要素 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj
 HSQC
HSQC