+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2l34 | ||||||
|---|---|---|---|---|---|---|---|
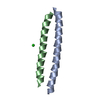
| タイトル | Structure of the DAP12 transmembrane homodimer | ||||||
 要素 要素 | TYRO protein tyrosine kinase-binding protein | ||||||
 キーワード キーワード | PROTEIN BINDING / Immunoreceptor / transmembrane assembly / DAP12 | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報myeloid leukocyte activation / positive regulation of receptor localization to synapse / stimulatory killer cell immunoglobulin-like receptor signaling pathway / natural killer cell mediated immunity / positive regulation of macrophage fusion / microglial cell activation involved in immune response / positive regulation of osteoclast development / negative regulation of transforming growth factor beta1 production / positive regulation of natural killer cell activation / positive regulation of microglial cell mediated cytotoxicity ...myeloid leukocyte activation / positive regulation of receptor localization to synapse / stimulatory killer cell immunoglobulin-like receptor signaling pathway / natural killer cell mediated immunity / positive regulation of macrophage fusion / microglial cell activation involved in immune response / positive regulation of osteoclast development / negative regulation of transforming growth factor beta1 production / positive regulation of natural killer cell activation / positive regulation of microglial cell mediated cytotoxicity / Other semaphorin interactions / T cell activation via T cell receptor contact with antigen bound to MHC molecule on antigen presenting cell / neutrophil activation involved in immune response / positive regulation of protein localization to cell surface / apoptotic cell clearance / Signal regulatory protein family interactions / negative regulation of type I interferon production / negative regulation of interleukin-10 production / negative regulation of B cell proliferation / stimulatory C-type lectin receptor signaling pathway / forebrain development / amyloid-beta clearance / semaphorin-plexin signaling pathway / negative regulation of long-term synaptic potentiation / response to axon injury / cellular defense response / positive regulation of superoxide anion generation / osteoclast differentiation / secretory granule membrane / DAP12 interactions / positive regulation of interleukin-1 beta production / integrin-mediated signaling pathway / positive regulation of interleukin-6 production / Immunoregulatory interactions between a Lymphoid and a non-Lymphoid cell / cellular response to amyloid-beta / positive regulation of tumor necrosis factor production / DAP12 signaling / actin cytoskeleton organization / protein-macromolecule adaptor activity / molecular adaptor activity / protein stabilization / intracellular signal transduction / signaling receptor binding / Neutrophil degranulation / positive regulation of gene expression / cell surface / signal transduction / protein homodimerization activity / metal ion binding / identical protein binding / membrane / plasma membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 溶液NMR / simulated annealing, molecular dynamics | ||||||
| Model details | lowest energy, model 1 | ||||||
 データ登録者 データ登録者 | Call, M.E. / Wucherpfennig, K.W. / Chou, J.J. | ||||||
 引用 引用 |  ジャーナル: Nat.Immunol. / 年: 2010 ジャーナル: Nat.Immunol. / 年: 2010タイトル: The structural basis for intramembrane assembly of an activating immunoreceptor complex. 著者: Call, M.E. / Wucherpfennig, K.W. / Chou, J.J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2l34.cif.gz 2l34.cif.gz | 290.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2l34.ent.gz pdb2l34.ent.gz | 243.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2l34.json.gz 2l34.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2l34_validation.pdf.gz 2l34_validation.pdf.gz | 351.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2l34_full_validation.pdf.gz 2l34_full_validation.pdf.gz | 492.9 KB | 表示 | |
| XML形式データ |  2l34_validation.xml.gz 2l34_validation.xml.gz | 16.3 KB | 表示 | |
| CIF形式データ |  2l34_validation.cif.gz 2l34_validation.cif.gz | 27.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/l3/2l34 https://data.pdbj.org/pub/pdb/validation_reports/l3/2l34 ftp://data.pdbj.org/pub/pdb/validation_reports/l3/2l34 ftp://data.pdbj.org/pub/pdb/validation_reports/l3/2l34 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質・ペプチド | 分子量: 3331.042 Da / 分子数: 2 / 断片: UNP RESIDUES 35-67 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: TYROBP, DAP12, KARAP / 発現宿主: Homo sapiens (ヒト) / 遺伝子: TYROBP, DAP12, KARAP / 発現宿主:  Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 試料状態 | イオン強度: 20 / pH: 6.8 / 圧: ambient / 温度: 303 K |
-NMR測定
| NMRスペクトロメーター | タイプ: Bruker Avance / 製造業者: Bruker / モデル: AVANCE / 磁場強度: 600 MHz |
|---|
- 解析
解析
| NMR software |
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: simulated annealing, molecular dynamics / ソフトェア番号: 1 | |||||||||||||||||||||
| 代表構造 | 選択基準: lowest energy | |||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: structures with the lowest energy 計算したコンフォーマーの数: 75 / 登録したコンフォーマーの数: 15 / 代表コンフォーマー: 1 |
 ムービー
ムービー コントローラー
コントローラー







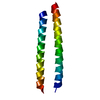






 PDBj
PDBj

 HSQC
HSQC