+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2j7q | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
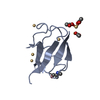
| タイトル | Crystal structure of the ubiquitin-specific protease encoded by murine cytomegalovirus tegument protein M48 in complex with a ubquitin-based suicide substrate | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | HYDROLASE / HERPESVIRIDAE / NUCLEAR PROTEIN / COVALENT ENZYME-LIGAND COMPLEX / DEUBIQUITINATING ENZYME / PAPAIN-LIKE FOLD / CYSTEINE PROTEASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / : / protein modification process => GO:0036211 / Peptide chain elongation / Selenocysteine synthesis / Formation of a pool of free 40S subunits / Eukaryotic Translation Termination / Response of EIF2AK4 (GCN2) to amino acid deficiency / SRP-dependent cotranslational protein targeting to membrane / Viral mRNA Translation ...: / : / protein modification process => GO:0036211 / Peptide chain elongation / Selenocysteine synthesis / Formation of a pool of free 40S subunits / Eukaryotic Translation Termination / Response of EIF2AK4 (GCN2) to amino acid deficiency / SRP-dependent cotranslational protein targeting to membrane / Viral mRNA Translation / Maturation of protein E / Maturation of protein E / Nonsense Mediated Decay (NMD) independent of the Exon Junction Complex (EJC) / GTP hydrolysis and joining of the 60S ribosomal subunit / ER Quality Control Compartment (ERQC) / Myoclonic epilepsy of Lafora / FLT3 signaling by CBL mutants / Prevention of phagosomal-lysosomal fusion / L13a-mediated translational silencing of Ceruloplasmin expression / IRAK2 mediated activation of TAK1 complex / Alpha-protein kinase 1 signaling pathway / Glycogen synthesis / IRAK1 recruits IKK complex / IRAK1 recruits IKK complex upon TLR7/8 or 9 stimulation / Membrane binding and targetting of GAG proteins / Endosomal Sorting Complex Required For Transport (ESCRT) / Regulation of TBK1, IKKε (IKBKE)-mediated activation of IRF3, IRF7 / Negative regulation of FLT3 / PTK6 Regulates RTKs and Their Effectors AKT1 and DOK1 / Regulation of TBK1, IKKε-mediated activation of IRF3, IRF7 upon TLR3 ligation / Constitutive Signaling by NOTCH1 HD Domain Mutants / IRAK2 mediated activation of TAK1 complex upon TLR7/8 or 9 stimulation / NOTCH2 Activation and Transmission of Signal to the Nucleus / Major pathway of rRNA processing in the nucleolus and cytosol / TICAM1,TRAF6-dependent induction of TAK1 complex / TICAM1-dependent activation of IRF3/IRF7 / APC/C:Cdc20 mediated degradation of Cyclin B / Regulation of FZD by ubiquitination / Downregulation of ERBB4 signaling / p75NTR recruits signalling complexes / APC-Cdc20 mediated degradation of Nek2A / InlA-mediated entry of Listeria monocytogenes into host cells / Regulation of pyruvate metabolism / TRAF6-mediated induction of TAK1 complex within TLR4 complex / TRAF6 mediated IRF7 activation in TLR7/8 or 9 signaling / Regulation of innate immune responses to cytosolic DNA / NF-kB is activated and signals survival / Nonsense Mediated Decay (NMD) enhanced by the Exon Junction Complex (EJC) / Downregulation of ERBB2:ERBB3 signaling / NRIF signals cell death from the nucleus / Pexophagy / VLDLR internalisation and degradation / Regulation of PTEN localization / Activated NOTCH1 Transmits Signal to the Nucleus / Regulation of BACH1 activity / MAP3K8 (TPL2)-dependent MAPK1/3 activation / Translesion synthesis by REV1 / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / InlB-mediated entry of Listeria monocytogenes into host cell / Translesion synthesis by POLK / Activation of IRF3, IRF7 mediated by TBK1, IKKε (IKBKE) / Downregulation of TGF-beta receptor signaling / Josephin domain DUBs / TICAM1, RIP1-mediated IKK complex recruitment / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 / Translesion synthesis by POLI / Gap-filling DNA repair synthesis and ligation in GG-NER / IKK complex recruitment mediated by RIP1 / Regulation of activated PAK-2p34 by proteasome mediated degradation / TGF-beta receptor signaling in EMT (epithelial to mesenchymal transition) / TNFR1-induced NF-kappa-B signaling pathway / PINK1-PRKN Mediated Mitophagy / TCF dependent signaling in response to WNT / cytosolic ribosome / Autodegradation of Cdh1 by Cdh1:APC/C / N-glycan trimming in the ER and Calnexin/Calreticulin cycle / APC/C:Cdc20 mediated degradation of Securin / activated TAK1 mediates p38 MAPK activation / Regulation of NF-kappa B signaling / Asymmetric localization of PCP proteins / Ubiquitin-dependent degradation of Cyclin D / Regulation of signaling by CBL / NIK-->noncanonical NF-kB signaling / NOTCH3 Activation and Transmission of Signal to the Nucleus / SCF-beta-TrCP mediated degradation of Emi1 / Deactivation of the beta-catenin transactivating complex / TNFR2 non-canonical NF-kB pathway / Negative regulation of FGFR3 signaling / AUF1 (hnRNP D0) binds and destabilizes mRNA / Fanconi Anemia Pathway / Negative regulators of DDX58/IFIH1 signaling / Vpu mediated degradation of CD4 / Assembly of the pre-replicative complex / Ubiquitin-Mediated Degradation of Phosphorylated Cdc25A / Negative regulation of FGFR2 signaling / Degradation of DVL / Peroxisomal protein import / Negative regulation of FGFR4 signaling / Stabilization of p53 / Dectin-1 mediated noncanonical NF-kB signaling 類似検索 - 分子機能 | |||||||||
| 生物種 |  MURINE CYTOMEGALOVIRUS (ヘルペスウイルス) MURINE CYTOMEGALOVIRUS (ヘルペスウイルス) HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単波長異常分散 / 解像度: 1.8 Å 単波長異常分散 / 解像度: 1.8 Å | |||||||||
 データ登録者 データ登録者 | Schlieker, C. / Weihofen, W.A. / Frijns, E. / Kattenhorn, L.M. / Gaudet, R. / Ploegh, H.L. | |||||||||
 引用 引用 |  ジャーナル: Mol.Cell / 年: 2007 ジャーナル: Mol.Cell / 年: 2007タイトル: Structure of a Herpesvirus-Encoded Cysteine Protease Reveals a Unique Class of Deubiquitinating Enzymes 著者: Schlieker, C. / Weihofen, W.A. / Frijns, E. / Kattenhorn, L.M. / Gaudet, R. / Ploegh, H.L. | |||||||||
| 履歴 |
| |||||||||
| Remark 700 | SHEET THE SHEET STRUCTURE OF THIS MOLECULE IS BIFURCATED. IN ORDER TO REPRESENT THIS FEATURE IN ... SHEET THE SHEET STRUCTURE OF THIS MOLECULE IS BIFURCATED. IN ORDER TO REPRESENT THIS FEATURE IN THE SHEET RECORDS BELOW, TWO SHEETS ARE DEFINED. |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2j7q.cif.gz 2j7q.cif.gz | 152.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2j7q.ent.gz pdb2j7q.ent.gz | 118.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2j7q.json.gz 2j7q.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2j7q_validation.pdf.gz 2j7q_validation.pdf.gz | 473.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2j7q_full_validation.pdf.gz 2j7q_full_validation.pdf.gz | 476.6 KB | 表示 | |
| XML形式データ |  2j7q_validation.xml.gz 2j7q_validation.xml.gz | 31.8 KB | 表示 | |
| CIF形式データ |  2j7q_validation.cif.gz 2j7q_validation.cif.gz | 48.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/j7/2j7q https://data.pdbj.org/pub/pdb/validation_reports/j7/2j7q ftp://data.pdbj.org/pub/pdb/validation_reports/j7/2j7q ftp://data.pdbj.org/pub/pdb/validation_reports/j7/2j7q | HTTPS FTP |
-関連構造データ
| 関連構造データ | |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||
| 2 | 
| ||||||||||||
| 単位格子 |
| ||||||||||||
| 非結晶学的対称性 (NCS) | NCS oper:
|
- 要素
要素
-MCMV TEGUMENT PROTEIN M48 ENCODED UBIQUITIN- SPECIFIC PROTEASE, ... , 2種, 2分子 AC
| #1: タンパク質 | 分子量: 25677.289 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: DEUBIQUITINATING MODULE OF MURINE CYTOMEGALOVIRUS TEGUMENT PROTEIN M48. ACTIVE SITE CYSTEINE 23 IS COVALENTLY LINKED TO THE FORMER VINYLMETHYLESTER MOIETY OF THE SUICIDE SUBSTATE UBVME 由来: (組換発現)  MURINE CYTOMEGALOVIRUS (ヘルペスウイルス) MURINE CYTOMEGALOVIRUS (ヘルペスウイルス)株: MCMV STRAIN SMITH / プラスミド: PET28 (NOVAGEN) / 発現宿主:  |
|---|---|
| #3: タンパク質 | 分子量: 25686.316 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: DEUBIQUITINATING MODULE OF MURINE CYTOMEGALOVIRUS TEGUMENT PROTEIN M48. ACTIVE SITE CYSTEINE 23 IS COVALENTLY LINKED TO THE FORMER VINYLMETHYLESTER MOIETY OF THE SUICIDE SUBSTATE UBVME 由来: (組換発現)  MURINE CYTOMEGALOVIRUS (ヘルペスウイルス) MURINE CYTOMEGALOVIRUS (ヘルペスウイルス)株: MCMV STRAIN SMITH / プラスミド: PET28 (NOVAGEN) / 発現宿主:  |
-タンパク質 , 1種, 2分子 BD
| #2: タンパク質 | 分子量: 8519.778 Da / 分子数: 2 Fragment: UBIQUITIN FUSED TO VINYLMETHYLESTER, UBVME, RESIDUES 1-75 由来タイプ: 組換発現 詳細: THE C-TERMINAL GLY 76 IS REPLACED BY THE VINYLMETHYLESTER MOIETY 由来: (組換発現)  HOMO SAPIENS (ヒト) / プラスミド: PTYB (NEW ENGLAND BIOLABS) / 発現宿主: HOMO SAPIENS (ヒト) / プラスミド: PTYB (NEW ENGLAND BIOLABS) / 発現宿主:  |
|---|
-非ポリマー , 5種, 714分子 








| #4: 化合物 | | #5: 化合物 | #6: 化合物 | ChemComp-PG4 / | #7: 化合物 | ChemComp-GOL / | #8: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.95 Å3/Da / 溶媒含有率: 36.49 % |
|---|---|
| 結晶化 | pH: 7.5 / 詳細: 200 MM MAGNESIUM FORMATE, 14% PEG 3350, pH 7.50 |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 24-ID-C / 波長: 0.9797 / ビームライン: 24-ID-C / 波長: 0.9797 |
| 検出器 | タイプ: ADSC CCD / 検出器: CCD / 日付: 2006年3月31日 |
| 放射 | モノクロメーター: SI 111 / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9797 Å / 相対比: 1 |
| 反射 | 解像度: 1.8→50 Å / Num. obs: 52323 / % possible obs: 97.4 % / Observed criterion σ(I): 2 / 冗長度: 4.2 % / Rmerge(I) obs: 0.09 / Net I/σ(I): 8.3 |
| 反射 シェル | 解像度: 1.8→1.86 Å / 冗長度: 2.4 % / Rmerge(I) obs: 0.27 / Mean I/σ(I) obs: 3.5 / % possible all: 84.2 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  単波長異常分散 / 解像度: 1.8→50 Å / Cor.coef. Fo:Fc: 0.96 / Cor.coef. Fo:Fc free: 0.925 / SU B: 4.84 / SU ML: 0.079 / TLS residual ADP flag: LIKELY RESIDUAL / 交差検証法: THROUGHOUT / ESU R: 0.123 / ESU R Free: 0.128 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS. 単波長異常分散 / 解像度: 1.8→50 Å / Cor.coef. Fo:Fc: 0.96 / Cor.coef. Fo:Fc free: 0.925 / SU B: 4.84 / SU ML: 0.079 / TLS residual ADP flag: LIKELY RESIDUAL / 交差検証法: THROUGHOUT / ESU R: 0.123 / ESU R Free: 0.128 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.4 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 10.21 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.8→50 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー










































 PDBj
PDBj


























