+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2ho2 | ||||||
|---|---|---|---|---|---|---|---|
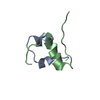
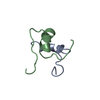
| タイトル | Structure of human FE65-WW domain in complex with hMena peptide. | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | PROTEIN BINDING / WW DOMAIN / BETA SHEET / FE65 | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報postsynaptic cytoskeleton organization / actin polymerization-dependent cell motility / negative regulation of cell cycle G1/S phase transition / profilin binding / Signaling by ROBO receptors / actin polymerization or depolymerization / proline-rich region binding / low-density lipoprotein particle receptor binding / WW domain binding / Generation of second messenger molecules ...postsynaptic cytoskeleton organization / actin polymerization-dependent cell motility / negative regulation of cell cycle G1/S phase transition / profilin binding / Signaling by ROBO receptors / actin polymerization or depolymerization / proline-rich region binding / low-density lipoprotein particle receptor binding / WW domain binding / Generation of second messenger molecules / smooth muscle contraction / axonogenesis / axon guidance / positive regulation of protein secretion / filopodium / positive regulation of neuron projection development / GABA-ergic synapse / SH3 domain binding / lamellipodium / Recruitment and ATM-mediated phosphorylation of repair and signaling proteins at DNA double strand breaks / amyloid-beta binding / actin binding / chromatin organization / growth cone / histone binding / molecular adaptor activity / transcription coactivator activity / cytoskeleton / postsynapse / nuclear speck / positive regulation of apoptotic process / focal adhesion / apoptotic process / synapse / ubiquitin protein ligase binding / DNA damage response / chromatin binding / regulation of DNA-templated transcription / positive regulation of DNA-templated transcription / endoplasmic reticulum / negative regulation of transcription by RNA polymerase II / signal transduction / positive regulation of transcription by RNA polymerase II / nucleoplasm / nucleus / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  多波長異常分散 / 解像度: 1.33 Å 多波長異常分散 / 解像度: 1.33 Å | ||||||
 データ登録者 データ登録者 | Meiyappan, M. / Birrane, G. / Ladias, J.A. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2007 ジャーナル: J.Mol.Biol. / 年: 2007タイトル: Structural Basis for Polyproline Recognition by the FE65 WW Domain. 著者: Meiyappan, M. / Birrane, G. / Ladias, J.A. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2ho2.cif.gz 2ho2.cif.gz | 31.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2ho2.ent.gz pdb2ho2.ent.gz | 21 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2ho2.json.gz 2ho2.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2ho2_validation.pdf.gz 2ho2_validation.pdf.gz | 437.2 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2ho2_full_validation.pdf.gz 2ho2_full_validation.pdf.gz | 437.7 KB | 表示 | |
| XML形式データ |  2ho2_validation.xml.gz 2ho2_validation.xml.gz | 4.6 KB | 表示 | |
| CIF形式データ |  2ho2_validation.cif.gz 2ho2_validation.cif.gz | 5.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ho/2ho2 https://data.pdbj.org/pub/pdb/validation_reports/ho/2ho2 ftp://data.pdbj.org/pub/pdb/validation_reports/ho/2ho2 ftp://data.pdbj.org/pub/pdb/validation_reports/ho/2ho2 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質・ペプチド | 分子量: 4194.533 Da / 分子数: 1 / 断片: WW domain / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: APBB1, FE65 / プラスミド: pGEX / 発現宿主: Homo sapiens (ヒト) / 遺伝子: APBB1, FE65 / プラスミド: pGEX / 発現宿主:  |
|---|---|
| #2: タンパク質・ペプチド | 分子量: 1005.206 Da / 分子数: 1 / 由来タイプ: 合成 詳細: The peptide was chemically synthesized. The sequence of the peptide is naturally found in Homo sapiens (human). 参照: UniProt: Q8N8S7 |
| #3: 化合物 | ChemComp-GOL / |
| #4: 水 | ChemComp-HOH / |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.86 Å3/Da / 溶媒含有率: 33.74 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 7.4 詳細: 1.85M Ammonium Sulfate, 0.1M HEPES, pH 7.4, VAPOR DIFFUSION, SITTING DROP, temperature 293K |
-データ収集
| 回折 | 平均測定温度: 95 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  NSLS NSLS  / ビームライン: X12B / 波長: 0.9792, 0.9793, 0.96 / ビームライン: X12B / 波長: 0.9792, 0.9793, 0.96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: ADSC QUANTUM 4 / 検出器: CCD / 日付: 2006年6月18日 / 詳細: DUAL SLITS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | モノクロメーター: SAGITALLY FOCUSED SI(111) / プロトコル: MAD / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.33→50 Å / Num. all: 9258 / Num. obs: 9129 / % possible obs: 98.6 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / 冗長度: 6.5 % / Rmerge(I) obs: 0.057 / Χ2: 1.075 / Net I/σ(I): 23.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  多波長異常分散 / 解像度: 1.33→17.03 Å / Cor.coef. Fo:Fc: 0.963 / Cor.coef. Fo:Fc free: 0.952 / SU B: 1.702 / SU ML: 0.032 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.064 / ESU R Free: 0.062 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS 多波長異常分散 / 解像度: 1.33→17.03 Å / Cor.coef. Fo:Fc: 0.963 / Cor.coef. Fo:Fc free: 0.952 / SU B: 1.702 / SU ML: 0.032 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.064 / ESU R Free: 0.062 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.4 Å / 溶媒モデル: BABINET MODEL WITH MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 16.478 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.33→17.03 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.33→1.369 Å / Total num. of bins used: 20
|
 ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj