Entry Database : PDB / ID : 1z4rTitle Human GCN5 Acetyltransferase General control of amino acid synthesis protein 5-like 2 Keywords / / / / / Function / homology Function Domain/homology Component
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / Biological species Homo sapiens (human)Method / / Resolution : 1.74 Å Authors Dong, A. / Bernstein, G. / Schuetz, A. / Antoshenko, T. / Wu, H. / Loppnau, P. / Sundstrom, M. / Arrowsmith, C. / Edwards, A. / Bochkarev, A. ...Dong, A. / Bernstein, G. / Schuetz, A. / Antoshenko, T. / Wu, H. / Loppnau, P. / Sundstrom, M. / Arrowsmith, C. / Edwards, A. / Bochkarev, A. / Plotnikov, A. / Structural Genomics Consortium (SGC) Journal : Proteins / Year : 2007Title : Crystal structure of a binary complex between human GCN5 histone acetyltransferase domain and acetyl coenzyme AAuthors : Schuetz, A. / Bernstein, G. / Dong, A. / Antoshenko, T. / Wu, H. / Loppnau, P. / Bochkarev, A. / Plotnikov, A.N. History Deposition Mar 16, 2005 Deposition site / Processing site Revision 1.0 Mar 29, 2005 Provider / Type Revision 1.1 Apr 30, 2008 Group Revision 1.2 Jul 13, 2011 Group Revision 1.3 Aug 23, 2023 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Refinement description Category chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / struct_ref_seq_dif / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id
Show all Show less
 Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information Homo sapiens (human)
Homo sapiens (human) X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  MOLECULAR REPLACEMENT / Resolution: 1.74 Å
MOLECULAR REPLACEMENT / Resolution: 1.74 Å  Authors
Authors Citation
Citation Journal: Proteins / Year: 2007
Journal: Proteins / Year: 2007 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 1z4r.cif.gz
1z4r.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb1z4r.ent.gz
pdb1z4r.ent.gz PDB format
PDB format 1z4r.json.gz
1z4r.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/z4/1z4r
https://data.pdbj.org/pub/pdb/validation_reports/z4/1z4r ftp://data.pdbj.org/pub/pdb/validation_reports/z4/1z4r
ftp://data.pdbj.org/pub/pdb/validation_reports/z4/1z4r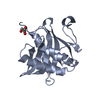
 Links
Links Assembly
Assembly
 Components
Components Homo sapiens (human) / Gene: GCN5 / Production host:
Homo sapiens (human) / Gene: GCN5 / Production host: 
 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation ROTATING ANODE / Type: RIGAKU FR-E / Wavelength: 1.5418
ROTATING ANODE / Type: RIGAKU FR-E / Wavelength: 1.5418  Processing
Processing MOLECULAR REPLACEMENT
MOLECULAR REPLACEMENT Movie
Movie Controller
Controller













 PDBj
PDBj






