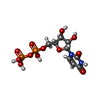
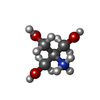
登録情報 データベース : PDB / ID : 1vztタイトル ROLES OF INDIVIDUAL RESIDUES OF ALPHA-1,3 GALACTOSYLTRANSFERASES IN SUBSTRATE BINDING AND CATALYSIS N-ACETYLLACTOSAMINIDE ALPHA-1,3-GALACTOSYLTRANSFERASE キーワード / / / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / 生物種 BOS TAURUS (ウシ)手法 / / / 解像度 : 2 Å データ登録者 Zhang, Y. / Swaminathan, G.J. / Deshpande, A. / Natesh, R. / Xie, X. / Acharya, K.R. / Brew, K. 履歴 登録 2004年5月26日 登録サイト / 処理サイト 置き換え 2005年5月26日 ID 1O7R 改定 1.0 2005年5月26日 Provider / タイプ 改定 1.1 2015年4月15日 Group Database references / Derived calculations ... Database references / Derived calculations / Non-polymer description / Other / Refinement description / Source and taxonomy / Version format compliance 改定 1.2 2018年2月7日 Group / カテゴリ / Item 改定 1.3 2023年12月13日 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Refinement description カテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id
すべて表示 表示を減らす Remark 700 SHEET THE SHEET STRUCTURE OF THIS MOLECULE IS BIFURCATED. IN ORDER TO REPRESENT THIS FEATURE IN ... SHEET THE SHEET STRUCTURE OF THIS MOLECULE IS BIFURCATED. IN ORDER TO REPRESENT THIS FEATURE IN THE SHEET RECORDS BELOW, TWO SHEETS ARE DEFINED.
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2 Å
分子置換 / 解像度: 2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Biochemistry / 年: 2003
ジャーナル: Biochemistry / 年: 2003 ジャーナル: J.Biol.Chem. / 年: 2001
ジャーナル: J.Biol.Chem. / 年: 2001 ジャーナル: Embo J. / 年: 2001
ジャーナル: Embo J. / 年: 2001 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1vzt.cif.gz
1vzt.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1vzt.ent.gz
pdb1vzt.ent.gz PDB形式
PDB形式 1vzt.json.gz
1vzt.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1vzt_validation.pdf.gz
1vzt_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1vzt_full_validation.pdf.gz
1vzt_full_validation.pdf.gz 1vzt_validation.xml.gz
1vzt_validation.xml.gz 1vzt_validation.cif.gz
1vzt_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/vz/1vzt
https://data.pdbj.org/pub/pdb/validation_reports/vz/1vzt ftp://data.pdbj.org/pub/pdb/validation_reports/vz/1vzt
ftp://data.pdbj.org/pub/pdb/validation_reports/vz/1vzt リンク
リンク 集合体
集合体


 要素
要素

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SRS
SRS  / ビームライン: PX14.1 / 波長: 1.488
/ ビームライン: PX14.1 / 波長: 1.488  解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj