+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1typ | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | SUBSTRATE INTERACTIONS BETWEEN TRYPANOTHIONE REDUCTASE AND N1-GLUTATHIONYLSPERMIDINE DISULPHIDE AT 0.28-NM RESOLUTION | ||||||
 要素 要素 | TRYPANOTHIONE REDUCTASE | ||||||
 キーワード キーワード | OXIDOREDUCTASE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報trypanothione-disulfide reductase / trypanothione-disulfide reductase (NADPH) activity / glutathione-disulfide reductase (NADPH) activity / glutathione metabolic process / cell redox homeostasis / flavin adenine dinucleotide binding / cellular response to oxidative stress / mitochondrion / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Crithidia fasciculata (真核生物) Crithidia fasciculata (真核生物) | ||||||
| 手法 |  X線回折 / 解像度: 2.8 Å X線回折 / 解像度: 2.8 Å | ||||||
 データ登録者 データ登録者 | Bailey, S. / Hunter, W.N. | ||||||
 引用 引用 |  ジャーナル: Eur.J.Biochem. / 年: 1993 ジャーナル: Eur.J.Biochem. / 年: 1993タイトル: Substrate interactions between trypanothione reductase and N1-glutathionylspermidine disulphide at 0.28-nm resolution. 著者: Bailey, S. / Smith, K. / Fairlamb, A.H. / Hunter, W.N. #1:  ジャーナル: J.Mol.Biol. / 年: 1992 ジャーナル: J.Mol.Biol. / 年: 1992タイトル: Active Site of Trypanothione Reductase: A Target for Rational Drug Design 著者: Hunter, W.N. / Bailey, S. / Habash, J. / Harrop, S.J. / Helliwell, J.R. / Abogye-Kwarteng, T. / Smith, K. / Fairlamb, A.H. #2:  ジャーナル: Science / 年: 1992 ジャーナル: Science / 年: 1992タイトル: Crystal Structures of Two Viral Peptides in Complex with Murine Mhc Class I H-2KB 著者: Fremont, D.H. / Matsumura, M. / Stura, E.A. / Peterson, P.A. / Wilson, I.A. #3:  ジャーナル: J.Mol.Biol. / 年: 1990 ジャーナル: J.Mol.Biol. / 年: 1990タイトル: Initiating a Crystallographic Study of Trypanothione Reductase 著者: Hunter, W.N. / Smith, K. / Derewenda, Z. / Harrop, S.J. / Habash, J. / Islam, M.S. / Helliwell, J.R. / Fairlamb, A.H. #4:  ジャーナル: Nature / 年: 1984 ジャーナル: Nature / 年: 1984タイトル: A Large Increase in Enzyme-Substrate Affinity by Protein Engineering 著者: Wilkinson, A.J. / Fersht, A.R. / Blow, D.M. / Carter, P. / Winter, G. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1typ.cif.gz 1typ.cif.gz | 213.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1typ.ent.gz pdb1typ.ent.gz | 168.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1typ.json.gz 1typ.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1typ_validation.pdf.gz 1typ_validation.pdf.gz | 2.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1typ_full_validation.pdf.gz 1typ_full_validation.pdf.gz | 2.6 MB | 表示 | |
| XML形式データ |  1typ_validation.xml.gz 1typ_validation.xml.gz | 46.2 KB | 表示 | |
| CIF形式データ |  1typ_validation.cif.gz 1typ_validation.cif.gz | 63.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ty/1typ https://data.pdbj.org/pub/pdb/validation_reports/ty/1typ ftp://data.pdbj.org/pub/pdb/validation_reports/ty/1typ ftp://data.pdbj.org/pub/pdb/validation_reports/ty/1typ | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Atom site foot note | 1: CIS PROLINE - PRO A 43 / 2: CIS PROLINE - PRO A 370 / 3: CIS PROLINE - PRO A 462 / 4: CIS PROLINE - PRO B 43 / 5: CIS PROLINE - PRO B 370 / 6: CIS PROLINE - PRO B 462 |
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 | 分子量: 52901.805 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Crithidia fasciculata (真核生物) / 参照: UniProt: P39040, EC: 1.6.4.8 Crithidia fasciculata (真核生物) / 参照: UniProt: P39040, EC: 1.6.4.8 |
|---|
-非ポリマー , 5種, 412分子 


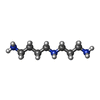





| #2: 化合物 | | #3: 化合物 | #4: 化合物 | ChemComp-GSH / #5: 化合物 | ChemComp-SPD / #6: 水 | ChemComp-HOH / | |
|---|
-詳細
| 非ポリマーの詳細 | N1-GLUTATHION |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.62 Å3/Da / 溶媒含有率: 66.07 % | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS 温度: 4 ℃ / pH: 7 / 手法: 蒸気拡散法, ハンギングドロップ法 | |||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 反射 | *PLUS 最高解像度: 2.8 Å / 最低解像度: 8.85 Å / Num. obs: 35848 / % possible obs: 70 % / Rmerge(I) obs: 0.096 |
|---|---|
| 反射 シェル | *PLUS 最高解像度: 2.8 Å / 最低解像度: 2.95 Å / % possible obs: 36.9 % / Num. possible: 5076 / Rmerge(I) obs: 0.24 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 2.8→8 Å / σ(F): 1 詳細: REFERENCE 1 DESCRIBES THE STRUCTURE SOLUTION BY MOLECULAR REPLACEMENT AND PARTIAL REFINEMENT TO ALLOW DETAILS OF THE ACTIVE SITE TO BE PRESENTED.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.8→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / 分類: refinement X-PLOR / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 2.8 Å / 最低解像度: 8 Å / Num. reflection obs: 32393 / σ(F): 1 / Rfactor obs: 0.148 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS タイプ: x_angle_d / Dev ideal: 3.3 |
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj









