[English] 日本語
 Yorodumi
Yorodumi- PDB-1n2e: Crystal Structure of a Pantothenate Synthetase from M. tuberculos... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 1n2e | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal Structure of a Pantothenate Synthetase from M. tuberculosis in complex with AMPCPP and pantoate | ||||||
 Components Components | pantothenate synthetase | ||||||
 Keywords Keywords | LIGASE / Structural genomics / Rossmann fold / dimer / intersubunit beta sheet / PSI / Protein Structure Initiative / TB Structural Genomics Consortium / TBSGC | ||||||
| Function / homology |  Function and homology information Function and homology informationbeta-alanine metabolic process / pantoate-beta-alanine ligase (AMP-forming) / pantoate-beta-alanine ligase activity / pantothenate biosynthetic process / manganese ion binding / magnesium ion binding / ATP binding / metal ion binding / cytoplasm / cytosol Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / rigid body refinement into new data / Resolution: 1.6 Å X-RAY DIFFRACTION / rigid body refinement into new data / Resolution: 1.6 Å | ||||||
 Authors Authors | Wang, S. / Eisenberg, D. / TB Structural Genomics Consortium (TBSGC) | ||||||
 Citation Citation |  Journal: Protein Sci. / Year: 2003 Journal: Protein Sci. / Year: 2003Title: Crystal structures of a pantothenate synthetase from M. tuberculosis and its complexes with substrates and a reaction intermediate Authors: Wang, S. / Eisenberg, D. | ||||||
| History |
| ||||||
| Remark 600 | HETEROGEN Entry 1N2B and this entry (1N2E) are two different experiments that together indicate ...HETEROGEN Entry 1N2B and this entry (1N2E) are two different experiments that together indicate that AMPCPP and pantoate cannot occupy the same active site simultaneously. The crystal for entry 1N2E was soaked in pantoate and AMPCPP overnight, and partial occupancy of AMPCPP and pantoate in subunit A was observed. The crystal for entry 1N2B was soaked in twice concentration of pantoate and same concentration of AMPCPP for over 24 hours, and this gave higher occupancy of pantoate, but lower occupancy of AMPCPP in subunit A. Both entries have full occupancy of AMPCPP in subunit B with a glycerol at the pantoate binding site. The structural difference between the two entries is higher occupancy of pantoate and lower occupancy of AMPCPP in subunit A of 1N2B relative to that of 1N2E. | ||||||
| Remark 999 | SEQUENCE RESIDUE 2 IS AN ALANINE IN THE SEQUENCE. MUTATION OF THIS RESIDUE WAS NECESSARY TO ... SEQUENCE RESIDUE 2 IS AN ALANINE IN THE SEQUENCE. MUTATION OF THIS RESIDUE WAS NECESSARY TO GENERATE AN NCOI RESTRICTION SITE FOR CLONING INTO THE EXPRESSION VECTOR PET30A. THE LAST 9 RESIDUES AFTER ARG300 WERE CLEAVED OFF BY ENTEROKINASE DIGESTION (UNINTENTIONALLY), WHICH WAS CARRIED OUT TO CLEAVE THE N-TERMINAL TAG FROM THE RECOMBINANT PROTEIN. |
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  1n2e.cif.gz 1n2e.cif.gz | 130.1 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb1n2e.ent.gz pdb1n2e.ent.gz | 100.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  1n2e.json.gz 1n2e.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/n2/1n2e https://data.pdbj.org/pub/pdb/validation_reports/n2/1n2e ftp://data.pdbj.org/pub/pdb/validation_reports/n2/1n2e ftp://data.pdbj.org/pub/pdb/validation_reports/n2/1n2e | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  1mopSC  1n2bC  1n2gC  1n2hC  1n2iC  1n2jC  1n2oC S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data | |
| Other databases |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
| ||||||||
| Details | The biological assembly is a dimer |
- Components
Components
-Protein , 1 types, 2 molecules AB
| #1: Protein | Mass: 31500.100 Da / Num. of mol.: 2 / Mutation: T2A, E77G Source method: isolated from a genetically manipulated source Source: (gene. exp.)   References: UniProt: P0A5R0, UniProt: P9WIL5*PLUS, pantoate-beta-alanine ligase (AMP-forming) |
|---|
-Non-polymers , 7 types, 420 molecules 
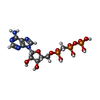
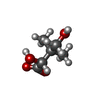

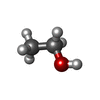








| #2: Chemical | | #3: Chemical | #4: Chemical | ChemComp-PAF / | #5: Chemical | #6: Chemical | ChemComp-EOH / #7: Chemical | ChemComp-MG / | #8: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.19 Å3/Da / Density % sol: 43.81 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, hanging drop / pH: 8 Details: PEG3000, lithium sulfate, magnesium sulfate, imidazole, ethanol, glycerol, pH 8.0, VAPOR DIFFUSION, HANGING DROP, temperature 293K |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: RIGAKU FR-D / Wavelength: 1.5418 ROTATING ANODE / Type: RIGAKU FR-D / Wavelength: 1.5418 |
| Detector | Type: RIGAKU RAXIS IV++ / Detector: IMAGE PLATE / Date: May 6, 2002 / Details: mirrors |
| Radiation | Monochromator: Ni filter / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.5418 Å / Relative weight: 1 |
| Reflection | Resolution: 1.6→50 Å / Num. all: 67182 / Num. obs: 67182 / % possible obs: 93.7 % / Observed criterion σ(I): -3 / Redundancy: 6.4 % / Biso Wilson estimate: 27.8 Å2 / Rmerge(I) obs: 0.066 / Rsym value: 0.066 / Net I/σ(I): 25.2 |
| Reflection shell | Resolution: 1.6→1.66 Å / Redundancy: 3.5 % / Rmerge(I) obs: 0.463 / Mean I/σ(I) obs: 2.6 / Num. unique all: 4197 / Rsym value: 0.463 / % possible all: 58.8 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure: rigid body refinement into new data Starting model: PDB entry 1MOP Resolution: 1.6→19.82 Å / Rfactor Rfree error: 0.003 / Isotropic thermal model: RESTRAINED / Cross valid method: THROUGHOUT / σ(F): 0 / Stereochemistry target values: Engh & Huber Details: full occupancy of AMPCPP in subunit B, partial occupancy of AMPCPP and pantoate in subunit A, at 1.6 A resolution.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Solvent model: FLAT MODEL / Bsol: 50.7372 Å2 / ksol: 0.377103 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 26.5 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.6→19.82 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.6→1.7 Å / Rfactor Rfree error: 0.013 / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
|
 Movie
Movie Controller
Controller





















 PDBj
PDBj














