+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1mrv | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | crystal structure of an inactive Akt2 kinase domain | ||||||
 要素 要素 | RAC-beta serine/threonine kinase | ||||||
 キーワード キーワード | TRANSFERASE / AGC serine threonine kinase / AKT PKB kinase domain / tumorigenesis / x-ray crystal structure / signal transduction | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報retinal rod cell apoptotic process / PDE3B signalling / cellular response to high light intensity / Inhibition of TSC complex formation by PKB / positive regulation of cap-dependent translational initiation / AKT-mediated inactivation of FOXO1A / negative regulation of long-chain fatty acid import across plasma membrane / Negative regulation of the PI3K/AKT network / Activation of AKT2 / AKT phosphorylates targets in the nucleus ...retinal rod cell apoptotic process / PDE3B signalling / cellular response to high light intensity / Inhibition of TSC complex formation by PKB / positive regulation of cap-dependent translational initiation / AKT-mediated inactivation of FOXO1A / negative regulation of long-chain fatty acid import across plasma membrane / Negative regulation of the PI3K/AKT network / Activation of AKT2 / AKT phosphorylates targets in the nucleus / positive regulation of glucose metabolic process / positive regulation of fatty acid beta-oxidation / RUNX2 regulates genes involved in cell migration / mammary gland epithelial cell differentiation / RAB GEFs exchange GTP for GDP on RABs / glycogen biosynthetic process / peripheral nervous system myelin maintenance / AKT phosphorylates targets in the cytosol / positive regulation of cell motility / Regulation of TP53 Activity through Association with Co-factors / Co-inhibition by CTLA4 / Constitutive Signaling by AKT1 E17K in Cancer / fat cell differentiation / negative regulation of PERK-mediated unfolded protein response / Regulation of MITF-M-dependent genes involved in pigmentation / Regulation of localization of FOXO transcription factors / CD28 dependent PI3K/Akt signaling / positive regulation of protein targeting to membrane / Estrogen-dependent nuclear events downstream of ESR-membrane signaling / Activation of BAD and translocation to mitochondria / positive regulation of glycogen biosynthetic process / SARS-CoV-2 targets host intracellular signalling and regulatory pathways / Cyclin E associated events during G1/S transition / Cyclin A:Cdk2-associated events at S phase entry / Regulation of TP53 Activity through Acetylation / FLT3 Signaling / Downregulation of ERBB2:ERBB3 signaling / regulation of cell migration / molecular function activator activity / VEGFR2 mediated vascular permeability / positive regulation of D-glucose import / protein localization to plasma membrane / TP53 Regulates Metabolic Genes / Translocation of SLC2A4 (GLUT4) to the plasma membrane / Deactivation of the beta-catenin transactivating complex / protein modification process / ruffle membrane / Regulation of PTEN stability and activity / glucose metabolic process / cellular response to insulin stimulus / KEAP1-NFE2L2 pathway / Regulation of TP53 Degradation / G beta:gamma signalling through PI3Kgamma / insulin receptor signaling pathway / PIP3 activates AKT signaling / cell cortex / early endosome / non-specific serine/threonine protein kinase / regulation of cell cycle / intracellular signal transduction / protein stabilization / positive regulation of cell migration / protein serine kinase activity / intracellular membrane-bounded organelle / protein serine/threonine kinase activity / signal transduction / nucleoplasm / ATP binding / metal ion binding / nucleus / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.8 Å 分子置換 / 解像度: 2.8 Å | ||||||
 データ登録者 データ登録者 | Huang, X. / Begley, M. / Morgenstern, K.A. / Gu, Y. / Rose, P. / Zhao, H. / Zhu, X. | ||||||
 引用 引用 |  ジャーナル: Structure / 年: 2003 ジャーナル: Structure / 年: 2003タイトル: Crystal structure of an inactive akt2 kinase domain 著者: Huang, X. / Begley, M. / Morgenstern, K.A. / Gu, Y. / Rose, P. / Zhao, H. / Zhu, X. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
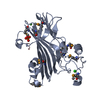
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1mrv.cif.gz 1mrv.cif.gz | 66.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1mrv.ent.gz pdb1mrv.ent.gz | 48.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1mrv.json.gz 1mrv.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/mr/1mrv https://data.pdbj.org/pub/pdb/validation_reports/mr/1mrv ftp://data.pdbj.org/pub/pdb/validation_reports/mr/1mrv ftp://data.pdbj.org/pub/pdb/validation_reports/mr/1mrv | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質 | 分子量: 39313.008 Da / 分子数: 1 / 断片: kinase domain / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: AKT2 Homo sapiens (ヒト) / 遺伝子: AKT2Plasmid details: gene cloned between BamHI & EcoRI, has His6 tag with thrombin cleavage site. プラスミド: pFastBac1 発現宿主:  参照: UniProt: P31751, 転移酵素; リンを含む基を移すもの; キナーゼ(アルコールにつなげるもの) |
|---|---|
| #2: 水 | ChemComp-HOH / |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.89 Å3/Da / 溶媒含有率: 57.44 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 8.5 詳細: Li2SO4, PEG4000, pH 8.5, VAPOR DIFFUSION, HANGING DROP, temperature 277K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 4 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 170 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ALS ALS  / ビームライン: 5.0.2 / 波長: 1 Å / ビームライン: 5.0.2 / 波長: 1 Å |
| 検出器 | タイプ: ADSC QUANTUM 4 / 検出器: CCD / 日付: 2001年3月15日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1 Å / 相対比: 1 |
| 反射 | 解像度: 2.4→100 Å / Num. obs: 17360 / Observed criterion σ(I): 0 / 冗長度: 3.97 % / Biso Wilson estimate: 51.93 Å2 / Rsym value: 0.078 / Net I/σ(I): 8.7 |
| 反射 | *PLUS 最高解像度: 2.8 Å / Num. obs: 11257 / % possible obs: 94.4 % / Num. measured all: 50158 / Rmerge(I) obs: 0.071 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PKA in ternary complex 解像度: 2.8→100 Å / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber
| |||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.8→100 Å
| |||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||
| 精密化 | *PLUS Rfactor Rfree: 0.307 / Rfactor Rwork: 0.257 | |||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | |||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | |||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj






















