[English] 日本語
 Yorodumi
Yorodumi- PDB-1lyx: Plasmodium Falciparum Triosephosphate Isomerase (PfTIM)-Phosphogl... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 1lyx | ||||||
|---|---|---|---|---|---|---|---|
| Title | Plasmodium Falciparum Triosephosphate Isomerase (PfTIM)-Phosphoglycolate complex | ||||||
 Components Components | Triosephosphate Isomerase | ||||||
 Keywords Keywords | ISOMERASE / TIM barrels / beta-alpha barrels | ||||||
| Function / homology |  Function and homology information Function and homology informationtriose-phosphate isomerase / triose-phosphate isomerase activity / glyceraldehyde-3-phosphate biosynthetic process / glycerol catabolic process / glycolytic process / gluconeogenesis / identical protein binding / cytosol Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  MOLECULAR REPLACEMENT / Resolution: 1.9 Å MOLECULAR REPLACEMENT / Resolution: 1.9 Å | ||||||
 Authors Authors | Parthasarathy, S. / Balaram, H. / Balaram, P. / Murthy, M.R. | ||||||
 Citation Citation |  Journal: Biochemistry / Year: 2002 Journal: Biochemistry / Year: 2002Title: Structure of the Plasmodium falciparum triosephosphate isomerase-phosphoglycolate complex in two crystal forms: characterization of catalytic loop open and closed conformations in the ligand-bound state Authors: Parthasarathy, S. / Ravindra, G. / Balaram, H. / Balaram, P. / Murthy, M.R. #1:  Journal: Structure / Year: 1997 Journal: Structure / Year: 1997Title: Triosephosphate isomerase from Plasmodium falciparum: Crystal structure provides insights into antimalarial drug design Authors: Velankar, S.S. / Ray, S.S. / Gokhle, R.S. / Suma, S. / Balaram, H. / Balaram, P. / Murthy, M.R.N. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  1lyx.cif.gz 1lyx.cif.gz | 66.1 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb1lyx.ent.gz pdb1lyx.ent.gz | 48.7 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  1lyx.json.gz 1lyx.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/ly/1lyx https://data.pdbj.org/pub/pdb/validation_reports/ly/1lyx ftp://data.pdbj.org/pub/pdb/validation_reports/ly/1lyx ftp://data.pdbj.org/pub/pdb/validation_reports/ly/1lyx | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  1lzoC  1ydvS C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||
| 2 | 
| ||||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 27997.738 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Gene: TPI / Plasmid: ptrc 99A vector, called pARC / Production host:  |
|---|---|
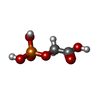
| #2: Chemical | ChemComp-PGA / |
| #3: Water | ChemComp-HOH / |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.4 Å3/Da / Density % sol: 46.74 % | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Crystal grow | Temperature: 295 K / Method: vapor diffusion, hanging drop / pH: 6.5 Details: 12% to 25% PEG 6000 or PEG 4000 or PEG 3350 or PEG 1450 in the presence of EDTA, DTT and Sodium azide in 100mM MES. pH 6.5, VAPOR DIFFUSION, HANGING DROP at 295K | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal grow | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||
| Components of the solutions | *PLUS
|
-Data collection
| Diffraction | Mean temperature: 295 K |
|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: RIGAKU RU200 / Wavelength: 1.5418 Å ROTATING ANODE / Type: RIGAKU RU200 / Wavelength: 1.5418 Å |
| Detector | Type: MARRESEARCH / Detector: IMAGE PLATE / Date: Feb 10, 2000 / Details: Mirrors |
| Radiation | Monochromator: Mirrors / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.5418 Å / Relative weight: 1 |
| Reflection | Resolution: 1.9→20 Å / Num. all: 20508 / Num. obs: 20508 / % possible obs: 98.4 % / Redundancy: 18.8 % / Rsym value: 0.068 |
| Reflection shell | Resolution: 1.9→1.97 Å / Num. unique all: 2008 / Rsym value: 0.215 / % possible all: 97.1 |
| Reflection | *PLUS Highest resolution: 1.9 Å / Num. obs: 10508 / Num. measured all: 198026 / Rmerge(I) obs: 0.068 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: Monomer of unbound PfTIM, PDB code 1YDV Resolution: 1.9→20 Å / Data cutoff high absF: 416213.98 / Data cutoff low absF: 0 / Isotropic thermal model: Isotropic / Cross valid method: THROUGHOUT / σ(F): 0.1 / Stereochemistry target values: Engh & Huber Details: Bulk solvent and anisotropic B-scaling were applied throughout the refinement
| ||||||||||||||||||||||||||||||||||||
| Solvent computation | Solvent model: FLAT MODEL / Bsol: 47.54 Å2 / ksol: 0.355873 e/Å3 | ||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 23.74 Å2
| ||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.9→20 Å
| ||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.9→1.97 Å / Total num. of bins used: 10
| ||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||
| Refinement | *PLUS Highest resolution: 1.9 Å / Rfactor Rfree: 0.211 / Rfactor Rwork: 0.18 | ||||||||||||||||||||||||||||||||||||
| Solvent computation | *PLUS | ||||||||||||||||||||||||||||||||||||
| Displacement parameters | *PLUS | ||||||||||||||||||||||||||||||||||||
| Refine LS restraints | *PLUS
|
 Movie
Movie Controller
Controller












 PDBj
PDBj