+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1kvo | ||||||
|---|---|---|---|---|---|---|---|
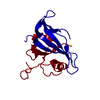
| タイトル | HUMAN PHOSPHOLIPASE A2 COMPLEXED WITH A HIGHLY POTENT SUBSTRATE ANOLOGUE | ||||||
 要素 要素 | HUMAN PHOSPHOLIPASE A2 | ||||||
 キーワード キーワード | HYDROLASE / LIPID DEGRADATION / MEMBRANE / CALCIUM | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of neutrophil activation / phosphatidylethanolamine metabolic process / phosphatidic acid metabolic process / Acyl chain remodelling of PG / Acyl chain remodelling of PC / Acyl chain remodelling of PI / Acyl chain remodelling of PS / Acyl chain remodelling of PE / Synthesis of PA / intestinal stem cell homeostasis ...regulation of neutrophil activation / phosphatidylethanolamine metabolic process / phosphatidic acid metabolic process / Acyl chain remodelling of PG / Acyl chain remodelling of PC / Acyl chain remodelling of PI / Acyl chain remodelling of PS / Acyl chain remodelling of PE / Synthesis of PA / intestinal stem cell homeostasis / phosphatidylglycerol metabolic process / phospholipase A2 activity / phosphatidylcholine metabolic process / phospholipase A2 / low-density lipoprotein particle remodeling / positive regulation of macrophage derived foam cell differentiation / calcium-dependent phospholipase A2 activity / Antimicrobial peptides / arachidonate secretion / lipid catabolic process / negative regulation of T cell proliferation / phospholipid metabolic process / secretory granule / angiotensin-activated signaling pathway / phospholipid binding / positive regulation of inflammatory response / killing of cells of another organism / mitochondrial outer membrane / positive regulation of ERK1 and ERK2 cascade / defense response to Gram-positive bacterium / inflammatory response / calcium ion binding / endoplasmic reticulum membrane / perinuclear region of cytoplasm / endoplasmic reticulum / extracellular space / extracellular exosome / extracellular region / plasma membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / 解像度: 2 Å X線回折 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | Cha, S.-S. / Abdel-Meguid, S.S. / Oh, B.-H. | ||||||
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 1996 ジャーナル: J.Med.Chem. / 年: 1996タイトル: High-resolution X-ray crystallography reveals precise binding interactions between human nonpancreatic secreted phospholipase A2 and a highly potent inhibitor (FPL67047XX). 著者: Cha, S.S. / Lee, D. / Adams, J. / Kurdyla, J.T. / Jones, C.S. / Marshall, L.A. / Bolognese, B. / Abdel-Meguid, S.S. / Oh, B.H. #1:  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: Structures of Free and Inhibited Human Secretory Phospholipase A2 from Inflammatory Exudate 著者: Scott, D.L. / White, S.P. / Browning, J.L. / Rosa, J.J. / Gelb, M.H. / Sigler, P.B. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1kvo.cif.gz 1kvo.cif.gz | 171.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1kvo.ent.gz pdb1kvo.ent.gz | 136.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1kvo.json.gz 1kvo.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1kvo_validation.pdf.gz 1kvo_validation.pdf.gz | 2.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1kvo_full_validation.pdf.gz 1kvo_full_validation.pdf.gz | 2.5 MB | 表示 | |
| XML形式データ |  1kvo_validation.xml.gz 1kvo_validation.xml.gz | 39.4 KB | 表示 | |
| CIF形式データ |  1kvo_validation.cif.gz 1kvo_validation.cif.gz | 52.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/kv/1kvo https://data.pdbj.org/pub/pdb/validation_reports/kv/1kvo ftp://data.pdbj.org/pub/pdb/validation_reports/kv/1kvo ftp://data.pdbj.org/pub/pdb/validation_reports/kv/1kvo | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 13945.012 Da / 分子数: 6 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 細胞株 (発現宿主): CHO CELLS Homo sapiens (ヒト) / 細胞株 (発現宿主): CHO CELLS発現宿主:  参照: UniProt: P14555, phospholipase A2 #2: 化合物 | ChemComp-CA / #3: 化合物 | ChemComp-OAP / #4: 水 | ChemComp-HOH / | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.48 Å3/Da / 溶媒含有率: 50.38 % | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS 温度: 7 ℃ / pH: 7.6 / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射光源 | 波長: 1.5418 |
|---|---|
| 検出器 | タイプ: MACSCIENCE / 検出器: IMAGE PLATE |
| 放射 | 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | Num. obs: 81302 / % possible obs: 95 % / Observed criterion σ(I): 1 / Rmerge(I) obs: 0.07 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 2→8 Å / σ(F): 1
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj