+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1h7x | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Dihydropyrimidine dehydrogenase (DPD) from pig, ternary complex of a mutant enzyme (C671A), NADPH and 5-fluorouracil | |||||||||
 要素 要素 | DIHYDROPYRIMIDINE DEHYDROGENASE | |||||||||
 キーワード キーワード | ELECTRON TRANSFER / FLAVIN / IRON-SULFUR CLUSTERS / PYRIMIDINE CATABOLISM / 5-FLUOROURACIL DEGRADATION / OXIDOREDUCTASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報dihydropyrimidine dehydrogenase (NADP+) / uracil binding / thymidine catabolic process / dihydropyrimidine dehydrogenase (NADP+) activity / beta-alanine biosynthetic process / uracil catabolic process / thymine catabolic process / FMN binding / flavin adenine dinucleotide binding / NADP binding ...dihydropyrimidine dehydrogenase (NADP+) / uracil binding / thymidine catabolic process / dihydropyrimidine dehydrogenase (NADP+) activity / beta-alanine biosynthetic process / uracil catabolic process / thymine catabolic process / FMN binding / flavin adenine dinucleotide binding / NADP binding / 4 iron, 4 sulfur cluster binding / protein homodimerization activity / metal ion binding / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.01 Å 分子置換 / 解像度: 2.01 Å | |||||||||
 データ登録者 データ登録者 | Dobritzsch, D. / Schneider, G. / Schnackerz, K.D. / Lindqvist, Y. | |||||||||
 引用 引用 |  ジャーナル: Embo J. / 年: 2001 ジャーナル: Embo J. / 年: 2001タイトル: Crystal Structure of Dihydropyrimidine Dehydrogenase, a Major Determinant of the Pharmacokinetics of the Anti-Cancer Drug 5-Fluorouracil 著者: Dobritzsch, D. / Schneider, G. / Schnackerz, K.D. / Lindqvist, Y. #1: ジャーナル: Acta Crystallogr.,Sect.D / 年: 2001 タイトル: Crystallization and Preliminary X-Ray Study of Pig Liver Dihydropyrimidine Dehydrogenase 著者: Dobritzsch, D. / Persson, K. / Schneider, G. / Lindqvist, Y. | |||||||||
| 履歴 |
| |||||||||
| Remark 700 | SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS "AF, BF, CF, DF" IN EACH CHAIN ON SHEET ... SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS "AF, BF, CF, DF" IN EACH CHAIN ON SHEET RECORDS ARE ACTUALLY AN 8-STRANDED BARREL THIS IS REPRESENTED BY A 9-STRANDED SHEET IN WHICH THE FIRST AND LAST STRANDS ARE IDENTICAL. |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1h7x.cif.gz 1h7x.cif.gz | 894.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1h7x.ent.gz pdb1h7x.ent.gz | 719 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1h7x.json.gz 1h7x.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1h7x_validation.pdf.gz 1h7x_validation.pdf.gz | 3.9 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1h7x_full_validation.pdf.gz 1h7x_full_validation.pdf.gz | 4 MB | 表示 | |
| XML形式データ |  1h7x_validation.xml.gz 1h7x_validation.xml.gz | 193.5 KB | 表示 | |
| CIF形式データ |  1h7x_validation.cif.gz 1h7x_validation.cif.gz | 286.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/h7/1h7x https://data.pdbj.org/pub/pdb/validation_reports/h7/1h7x ftp://data.pdbj.org/pub/pdb/validation_reports/h7/1h7x ftp://data.pdbj.org/pub/pdb/validation_reports/h7/1h7x | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||
| 2 | 
| ||||||||||||||||
| 単位格子 |
| ||||||||||||||||
| 非結晶学的対称性 (NCS) | NCS oper:
|
- 要素
要素
-タンパク質 , 1種, 4分子 ABCD
| #1: タンパク質 | 分子量: 111571.281 Da / 分子数: 4 / 変異: YES / 由来タイプ: 組換発現 / 由来: (組換発現)   参照: UniProt: Q28943, dihydropyrimidine dehydrogenase (NADP+) |
|---|
-非ポリマー , 6種, 4321分子 



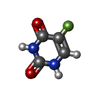






| #2: 化合物 | ChemComp-SF4 / #3: 化合物 | ChemComp-FMN / #4: 化合物 | ChemComp-FAD / #5: 化合物 | ChemComp-NDP / #6: 化合物 | ChemComp-URF / #7: 水 | ChemComp-HOH / | |
|---|
-詳細
| 構成要素の詳細 | CHAIN A, B, C, D ENGINEERED MUTATION CYS671ALA INVOLVED IN THE CATABOLISM OF URACIL AND THYMIDINE ...CHAIN A, B, C, D ENGINEERED |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.4 Å3/Da / 溶媒含有率: 50 % | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 4.7 詳細: 100 MM SODIUM CITRATE PH 4.7, 16-20 % POLYETHYLENE GLYCOL 6000, 1 MM DTT, 1 MM NADPH, 5 MM 5FU | |||||||||||||||
| 結晶化 | *PLUS 温度: 20 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法 | |||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  MAX II MAX II  / ビームライン: I711 / 波長: 0.9746 / ビームライン: I711 / 波長: 0.9746 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 2000年3月15日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9746 Å / 相対比: 1 |
| 反射 | 解像度: 2→30 Å / Num. obs: 274925 / % possible obs: 99 % / 冗長度: 2.8 % / Biso Wilson estimate: 8.7 Å2 / Rsym value: 0.063 / Net I/σ(I): 10.4 |
| 反射 シェル | 解像度: 2→2.11 Å / 冗長度: 2.4 % / Mean I/σ(I) obs: 4.4 / Rsym value: 0.166 / % possible all: 95.8 |
| 反射 | *PLUS Num. measured all: 1471519 / Rmerge(I) obs: 0.063 |
| 反射 シェル | *PLUS % possible obs: 95.8 % / Rmerge(I) obs: 0.166 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: DIHYDROPYRIMIDINE DEHYDROGENASE, UNCOMPLEXED 解像度: 2.01→25.08 Å / Rfactor Rfree error: 0.003 / Data cutoff high absF: 4072791.96 / Isotropic thermal model: OVERALL / 交差検証法: THROUGHOUT / σ(F): 0 詳細: THE C-TERMINAL RESIDUES WERE NOT SEEN IN THE DENSITY
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 48 Å2 / ksol: 0.371281 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 21 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.01→25.08 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS | Rms dev Biso : 2 Å2 / Rms dev position: 0.16 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2→2.09 Å / Rfactor Rfree error: 0.01 / Total num. of bins used: 8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: CNS / バージョン: 1 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj
















