+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 1fy3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | [G175Q]HBP, A mutant of human heparin binding protein (CAP37) | |||||||||
 Components Components | HEPARIN-BINDING PROTEIN | |||||||||
 Keywords Keywords | ANTIMICROBIAL PROTEIN / Serine protease homolog / BPTI binding site | |||||||||
| Function / homology |  Function and homology information Function and homology informationmonocyte extravasation / neutrophil-mediated killing of bacterium / monocyte activation / cellular extravasation / positive regulation of fractalkine production / glial cell migration / induction of positive chemotaxis / regulation of vascular permeability / antimicrobial humoral response / positive regulation of MHC class II biosynthetic process ...monocyte extravasation / neutrophil-mediated killing of bacterium / monocyte activation / cellular extravasation / positive regulation of fractalkine production / glial cell migration / induction of positive chemotaxis / regulation of vascular permeability / antimicrobial humoral response / positive regulation of MHC class II biosynthetic process / heparan sulfate proteoglycan binding / azurophil granule / azurophil granule membrane / macrophage chemotaxis / toxic substance binding / positive regulation of cell adhesion / positive regulation of phagocytosis / positive regulation of interleukin-1 beta production / cell chemotaxis / protein maturation / microglial cell activation / positive regulation of tumor necrosis factor production / azurophil granule lumen / peptidase activity / heparin binding / phospholipase C-activating G protein-coupled receptor signaling pathway / defense response to virus / defense response to Gram-negative bacterium / intracellular signal transduction / inflammatory response / serine-type endopeptidase activity / Neutrophil degranulation / negative regulation of apoptotic process / proteolysis / extracellular space / extracellular exosome / extracellular region / membrane Similarity search - Function | |||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / Resolution: 1.89 Å SYNCHROTRON / Resolution: 1.89 Å | |||||||||
 Authors Authors | Kastrup, J.S. / Linde, V. / Pedersen, A.K. / Stoffer, B. / Iversen, L.F. / Larsen, I.K. / Rasmussen, P.B. / Flodgaard, H.J. / Bjorn, S.E. | |||||||||
 Citation Citation |  Journal: Proteins / Year: 2001 Journal: Proteins / Year: 2001Title: Two mutants of human heparin binding protein (CAP37): toward the understanding of the nature of lipid A/LPS and BPTI binding. Authors: Kastrup, J.S. / Linde, V. / Pedersen, A.K. / Stoffer, B. / Iversen, L.F. / Larsen, I.K. / Rasmussen, P.B. / Flodgaard, H.J. / Bjorn, S.E. #1:  Journal: Acta Crystallogr.,Sect.D / Year: 1998 Journal: Acta Crystallogr.,Sect.D / Year: 1998Title: Atomic resolution structure of human HBP/CAP37/Azurocidin Authors: Karlsen, S. / Iversen, L.F. / Larsen, I.K. / Flodgaard, H.J. / Kastrup, J.S. #2:  Journal: Nat.Struct.Biol. / Year: 1997 Journal: Nat.Struct.Biol. / Year: 1997Title: Structure of HBP, a multifunctional protein with a serine proteinase fold Authors: Iversen, L.F. / Kastrup, J.S. / Bjorn, S.E. / Rasmussen, P.B. / Wiberg, F.C. / Flodgaard, H.J. / Larsen, I.K. #3:  Journal: Acta Crystallogr.,Sect.D / Year: 1996 Journal: Acta Crystallogr.,Sect.D / Year: 1996Title: Crystallization and Molecular Replacement Solution of Human Heparin Binding Protein Authors: Iversen, L.F. / Kastrup, J.S. / Larsen, I.K. / Bjorn, S.E. / Rasmussen, P.B. / Wiberg, F.C. / Flodgaard, H.J. #4:  Journal: Protein Sci. / Year: 1999 Journal: Protein Sci. / Year: 1999Title: Structure and function of the N-linked glycans of HBP/CAP37/azurocidin: Crystal structure determination and biological characterization of nonglycosylated HBP Authors: Iversen, L.F. / Kastrup, J.S. / Bjorn, S.E. / Wiberg, F.C. / Larsen, I.K. / Flodgaard, H.J. / Rasmussen, P.B. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  1fy3.cif.gz 1fy3.cif.gz | 63.2 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb1fy3.ent.gz pdb1fy3.ent.gz | 44.3 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  1fy3.json.gz 1fy3.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/fy/1fy3 https://data.pdbj.org/pub/pdb/validation_reports/fy/1fy3 ftp://data.pdbj.org/pub/pdb/validation_reports/fy/1fy3 ftp://data.pdbj.org/pub/pdb/validation_reports/fy/1fy3 | HTTPS FTP |
|---|
-Related structure data
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
| ||||||||
| Details | The biological unit is a monomer |
- Components
Components
-Protein , 1 types, 1 molecules A
| #1: Protein | Mass: 24373.553 Da / Num. of mol.: 1 / Mutation: G175Q Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Cell line (production host): SF-900 / Production host: Homo sapiens (human) / Cell line (production host): SF-900 / Production host:  unidentified baculovirus / Strain (production host): ACMNPV / References: UniProt: P20160 unidentified baculovirus / Strain (production host): ACMNPV / References: UniProt: P20160 |
|---|
-Sugars , 2 types, 2 molecules 
| #2: Polysaccharide | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose Source method: isolated from a genetically manipulated source |
|---|---|
| #3: Sugar | ChemComp-NAG / |
-Non-polymers , 3 types, 235 molecules 
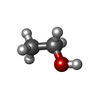



| #4: Chemical | ChemComp-CL / |
|---|---|
| #5: Chemical | ChemComp-EOH / |
| #6: Water | ChemComp-HOH / |
-Details
| Has protein modification | Y |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.55 Å3/Da / Density % sol: 51.84 % | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, hanging drop / pH: 7.2 Details: Ethanol, glycerol, TRIS, pH 7.2, VAPOR DIFFUSION, HANGING DROP, temperature 293K | |||||||||||||||||||||||||
| Crystal grow | *PLUS | |||||||||||||||||||||||||
| Components of the solutions | *PLUS
|
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  MAX II MAX II  / Beamline: I711 / Wavelength: 0.996 / Beamline: I711 / Wavelength: 0.996 |
| Detector | Type: MARRESEARCH / Detector: IMAGE PLATE / Date: Aug 20, 1998 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.996 Å / Relative weight: 1 |
| Reflection | Resolution: 1.89→20 Å / Num. all: 18582 / Num. obs: 18582 / % possible obs: 89.3 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / Redundancy: 5.5 % / Biso Wilson estimate: 14.7 Å2 / Rmerge(I) obs: 0.063 / Net I/σ(I): 14.7 |
| Reflection shell | Resolution: 1.89→1.92 Å / Redundancy: 5.5 % / Rmerge(I) obs: 0.269 / Num. unique all: 885 / % possible all: 87.7 |
| Reflection | *PLUS Num. measured all: 102404 |
| Reflection shell | *PLUS % possible obs: 87.7 % / Mean I/σ(I) obs: 2.8 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Resolution: 1.89→20 Å / σ(F): 1 / σ(I): 1 / Stereochemistry target values: TNT PROTGEO
| |||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.89→20 Å
| |||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||
| Software | *PLUS Name: TNT / Classification: refinement | |||||||||||||||||||||||||
| Refinement | *PLUS Lowest resolution: 20 Å / σ(F): 1 / Rfactor obs: 0.182 | |||||||||||||||||||||||||
| Solvent computation | *PLUS | |||||||||||||||||||||||||
| Displacement parameters | *PLUS | |||||||||||||||||||||||||
| Refine LS restraints | *PLUS
|
 Movie
Movie Controller
Controller
















 PDBj
PDBj







