+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1dra | ||||||
|---|---|---|---|---|---|---|---|
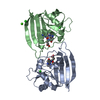
| タイトル | CRYSTAL STRUCTURE OF UNLIGANDED ESCHERICHIA COLI DIHYDROFOLATE REDUCTASE. LIGAND-INDUCED CONFORMATIONAL CHANGES AND COOPERATIVITY IN BINDING | ||||||
 要素 要素 | DIHYDROFOLATE REDUCTASE | ||||||
 キーワード キーワード | OXIDOREDUCTASE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報methotrexate binding / dihydrofolic acid binding / 10-formyltetrahydrofolate biosynthetic process / response to methotrexate / NADP+ binding / folic acid biosynthetic process / folic acid binding / dihydrofolate metabolic process / dihydrofolate reductase / dihydrofolate reductase activity ...methotrexate binding / dihydrofolic acid binding / 10-formyltetrahydrofolate biosynthetic process / response to methotrexate / NADP+ binding / folic acid biosynthetic process / folic acid binding / dihydrofolate metabolic process / dihydrofolate reductase / dihydrofolate reductase activity / folic acid metabolic process / NADPH binding / tetrahydrofolate biosynthetic process / one-carbon metabolic process / NADP binding / response to xenobiotic stimulus / response to antibiotic / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / 解像度: 1.9 Å X線回折 / 解像度: 1.9 Å | ||||||
 データ登録者 データ登録者 | Oatley, S.J. / Kraut, J. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 1991 ジャーナル: Biochemistry / 年: 1991タイトル: Crystal structure of unliganded Escherichia coli dihydrofolate reductase. Ligand-induced conformational changes and cooperativity in binding. 著者: Bystroff, C. / Kraut, J. #1:  ジャーナル: Biochemistry / 年: 1990 ジャーナル: Biochemistry / 年: 1990タイトル: Crystal Structures of Escherichia Coli Dihydrofolate Reductase: The Nadp+ Holoenzyme and the Folate Nadp+ Ternary Complex. Substrate Binding and a Model for the Transition State 著者: Bystroff, C. / Oatley, S.J. / Kraut, J. #2:  ジャーナル: Biochemistry / 年: 1990 ジャーナル: Biochemistry / 年: 1990タイトル: Crystal Structures of Recombinant Human Dihydrofolate Reductase Complexed with Folate and 5-Deazafolate 著者: Davies II, J.F. / Delcamp, T.J. / Prendergast, N.J. / Ashford, V.A. / Freisheim, J.H. / Kraut, J. #3:  ジャーナル: Science / 年: 1986 ジャーナル: Science / 年: 1986タイトル: Functional Role of Aspartic Acid-27 in Dihydrofolate Reductase Revealed by Mutagenesis 著者: Howell, E.E. / Villafranca, J.E. / Warren, M.S. / Oatley, S.J. / Kraut, J. #4:  ジャーナル: J.Biol.Chem. / 年: 1982 ジャーナル: J.Biol.Chem. / 年: 1982タイトル: Crystal Structures of Escherichia Coli and Lactobacillus Casei Dihydrofolate Reductase Refined at 1.7 Angstroms Resolution. I. General Features and Binding of Methotrexate 著者: Bolin, J.T. / Filman, D.J. / Matthews, D.A. / Hamlin, R.C. / Kraut, J. #5:  ジャーナル: J.Biol.Chem. / 年: 1982 ジャーナル: J.Biol.Chem. / 年: 1982タイトル: Crystal Structures of Escherichia Coli and Lactobacillus Casei Dihydrofolate Reductase Refined at 1.7 Angstroms Resolution. II. Environment of Bound Nadph and Implications for Catalysis 著者: Filman, D.J. / Bolin, J.T. / Matthews, D.A. / Kraut, J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1dra.cif.gz 1dra.cif.gz | 88.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1dra.ent.gz pdb1dra.ent.gz | 66.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1dra.json.gz 1dra.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1dra_validation.pdf.gz 1dra_validation.pdf.gz | 500.9 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1dra_full_validation.pdf.gz 1dra_full_validation.pdf.gz | 514.5 KB | 表示 | |
| XML形式データ |  1dra_validation.xml.gz 1dra_validation.xml.gz | 11 KB | 表示 | |
| CIF形式データ |  1dra_validation.cif.gz 1dra_validation.cif.gz | 17.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/dr/1dra https://data.pdbj.org/pub/pdb/validation_reports/dr/1dra ftp://data.pdbj.org/pub/pdb/validation_reports/dr/1dra ftp://data.pdbj.org/pub/pdb/validation_reports/dr/1dra | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Atom site foot note | 1: GLY A 95 - GLY A 96 OMEGA ANGLE = 2.684 PEPTIDE BOND DEVIATES SIGNIFICANTLY FROM TRANS CONFORMATION 2: GLY B 95 - GLY B 96 OMEGA ANGLE = 2.555 PEPTIDE BOND DEVIATES SIGNIFICANTLY FROM TRANS CONFORMATION | ||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (-0.92567, -0.3718, 0.07002), ベクター: 詳細 | THE TRANSFORMATION PRESENTED ON *MTRIX* RECORDS BELOW WILL YIELD APPROXIMATE COORDINATES FOR CHAIN *A* WHEN APPLIED TO CHAIN *B*. | |
- 要素
要素
| #1: タンパク質 | 分子量: 18034.352 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  #2: 化合物 | #3: 化合物 | #4: 化合物 | ChemComp-CA / | #5: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.55 Å3/Da / 溶媒含有率: 51.77 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS 温度: 4 ℃ / pH: 5.4 / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射 | 散乱光タイプ: x-ray |
|---|---|
| 放射波長 | 相対比: 1 |
- 解析
解析
| ソフトウェア | 名称: PROLSQ / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 1.9→5 Å 詳細: DURING THE REFINEMENT THE CALCIUM ION (DESIGNATED CA) AND THE TWO CHLORIDE IONS (DESIGNATED CL) WERE MODELED AS OXYGEN ATOMS.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.9→5 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: PROLSQ / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 1.9 Å / 最低解像度: 5 Å / Num. reflection obs: 26188 / Rfactor obs: 0.153 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS |
 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj