+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1bte | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CRYSTAL STRUCTURE OF THE EXTRACELLULAR DOMAIN OF THE TYPE II ACTIVIN RECEPTOR | |||||||||
 要素 要素 | PROTEIN (ACTIVIN RECEPTOR TYPE II) | |||||||||
 キーワード キーワード | TRANSFERASE / RECEPTOR / SERINE KINASE / LIGAND BINDING DOMAIN / THREE-FINGER TOXIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報TGFBR3 regulates activin signaling / Signaling by Activin / inhibin binding / inhibin-betaglycan-ActRII complex / Signaling by BMP / activin receptor activity / penile erection / activin receptor activity, type II / sperm ejaculation / positive regulation of activin receptor signaling pathway ...TGFBR3 regulates activin signaling / Signaling by Activin / inhibin binding / inhibin-betaglycan-ActRII complex / Signaling by BMP / activin receptor activity / penile erection / activin receptor activity, type II / sperm ejaculation / positive regulation of activin receptor signaling pathway / Sertoli cell proliferation / BMP receptor activity / embryonic skeletal system development / activin receptor activity, type I / receptor protein serine/threonine kinase / activin binding / gastrulation with mouth forming second / regulation of nitric oxide biosynthetic process / determination of left/right symmetry / anterior/posterior pattern specification / growth factor binding / odontogenesis of dentin-containing tooth / mesoderm development / positive regulation of SMAD protein signal transduction / regulation of signal transduction / positive regulation of osteoblast differentiation / positive regulation of bone mineralization / BMP signaling pathway / coreceptor activity / positive regulation of erythrocyte differentiation / PDZ domain binding / male gonad development / osteoblast differentiation / spermatogenesis / receptor complex / protein serine/threonine kinase activity / cell surface / positive regulation of transcription by RNA polymerase II / ATP binding / metal ion binding / identical protein binding / plasma membrane / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  多重同系置換・異常分散 / 解像度: 1.5 Å 多重同系置換・異常分散 / 解像度: 1.5 Å | |||||||||
 データ登録者 データ登録者 | Greenwald, J. / Fischer, W. / Vale, W. / Choe, S. | |||||||||
 引用 引用 |  ジャーナル: Nat.Struct.Biol. / 年: 1999 ジャーナル: Nat.Struct.Biol. / 年: 1999タイトル: Three-finger toxin fold for the extracellular ligand-binding domain of the type II activin receptor serine kinase. 著者: Greenwald, J. / Fischer, W.H. / Vale, W.W. / Choe, S. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1bte.cif.gz 1bte.cif.gz | 57 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1bte.ent.gz pdb1bte.ent.gz | 40.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1bte.json.gz 1bte.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1bte_validation.pdf.gz 1bte_validation.pdf.gz | 392.5 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1bte_full_validation.pdf.gz 1bte_full_validation.pdf.gz | 394.1 KB | 表示 | |
| XML形式データ |  1bte_validation.xml.gz 1bte_validation.xml.gz | 5.6 KB | 表示 | |
| CIF形式データ |  1bte_validation.cif.gz 1bte_validation.cif.gz | 9.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/bt/1bte https://data.pdbj.org/pub/pdb/validation_reports/bt/1bte ftp://data.pdbj.org/pub/pdb/validation_reports/bt/1bte ftp://data.pdbj.org/pub/pdb/validation_reports/bt/1bte | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 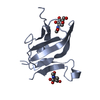
| ||||||||||||
| 2 | 
| ||||||||||||
| 単位格子 |
| ||||||||||||
| Components on special symmetry positions |
| ||||||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (0.8945, -0.4458, -0.0349), ベクター: |
- 要素
要素
| #1: タンパク質 | 分子量: 11507.803 Da / 分子数: 2 / 断片: LIGAND-BINDING DOMAIN / 由来タイプ: 組換発現 / 由来: (組換発現)   Pichia pastoris (菌類) / 株 (発現宿主): SMD1168 Pichia pastoris (菌類) / 株 (発現宿主): SMD1168参照: UniProt: P27038, 転移酵素; リンを含む基を移すもの; キナーゼ(アルコールにつなげるもの) #2: 糖 | ChemComp-NAG / #3: 水 | ChemComp-HOH / | 構成要素の詳細 | GLYCOSYLATION FROM HOST EXPRESSION SYSTEM WAS REMOVED USING ENDOGLYCOSIDASE H, LEAVING BEHIND THE N- ...GLYCOSYLAT | Has protein modification | Y | 非ポリマーの詳細 | O6 OF NAG A 124 AND NAG B 124 IS MODELED IN TWO ALTERNATIV | 配列の詳細 | THE NUMBERING OF RESIDUES IN THE PDB FILE IS BASED ON THE SEQUENCE WITHOUT THE SIGNAL PEPTIDE. THE ...THE NUMBERING OF RESIDUES IN THE PDB FILE IS BASED ON THE SEQUENCE WITHOUT THE SIGNAL PEPTIDE. THE MOLECULE IN THE CRYSTAL IS LACKING THE 14 C-TERMINAL RESIDUES WHICH HAVE BEEN REMOVED BY TREATMENT WITH ENDOPROTEI | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.4 Å3/Da / 溶媒含有率: 42 % | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 4.5 詳細: 100 MM SODIUM ACETATE, PH 4.5, 5% PEG 8000, 0.5M NACL | ||||||||||||||||||||||||
| 結晶 | *PLUS 溶媒含有率: 43 % | ||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: unknown | ||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ALS ALS  / ビームライン: 5.0.2 / 波長: 0.97 / ビームライン: 5.0.2 / 波長: 0.97 |
| 検出器 | タイプ: ADSC / 検出器: CCD / 日付: 1998年1月15日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.97 Å / 相対比: 1 |
| 反射 | 解像度: 1.5→50 Å / Num. obs: 30005 / % possible obs: 83.9 % / 冗長度: 4.2 % / Biso Wilson estimate: 18.1 Å2 / Rsym value: 0.034 / Net I/σ(I): 11.6 |
| 反射 シェル | 解像度: 1.5→1.54 Å / 冗長度: 2.9 % / Mean I/σ(I) obs: 0.3 / Rsym value: 0.295 / % possible all: 37.3 |
| 反射 | *PLUS Rmerge(I) obs: 0.034 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  多重同系置換・異常分散 / 解像度: 1.5→20 Å / SU ML: 0.063 / σ(F): 0 / ESU R: 0.086 / ESU R Free: 0.092 多重同系置換・異常分散 / 解像度: 1.5→20 Å / SU ML: 0.063 / σ(F): 0 / ESU R: 0.086 / ESU R Free: 0.092
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 23.6 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.5→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: REFMAC / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 1.5 Å / σ(F): 0 / % reflection Rfree: 5 % / Rfactor obs: 0.181 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS Biso mean: 23.6 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj



