+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9232 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human AA amyloid fibril | |||||||||
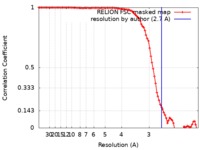
 マップデータ マップデータ | Cryo-EM reconstruction of human Serum Amyloid A fibrils, extracted from diseased human kidney. The fibril shows a helical rise of 2.40 A, a helical twist of 180.79 degree and a resolution of 2.7 A. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | AA-amyloidosis / Serum Amyloid A / cross-beta / helical / protein fibril | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報lymphocyte chemotaxis / Scavenging by Class B Receptors / positive regulation of interleukin-1 production / high-density lipoprotein particle / Formyl peptide receptors bind formyl peptides and many other ligands / regulation of protein secretion / macrophage chemotaxis / TRAF6 mediated NF-kB activation / Advanced glycosylation endproduct receptor signaling / cytoplasmic microtubule ...lymphocyte chemotaxis / Scavenging by Class B Receptors / positive regulation of interleukin-1 production / high-density lipoprotein particle / Formyl peptide receptors bind formyl peptides and many other ligands / regulation of protein secretion / macrophage chemotaxis / TRAF6 mediated NF-kB activation / Advanced glycosylation endproduct receptor signaling / cytoplasmic microtubule / neutrophil chemotaxis / endocytic vesicle lumen / positive regulation of cell adhesion / positive regulation of cytokine production / acute-phase response / G protein-coupled receptor binding / TAK1-dependent IKK and NF-kappa-B activation / platelet activation / negative regulation of inflammatory response / heparin binding / positive regulation of cytosolic calcium ion concentration / Interleukin-4 and Interleukin-13 signaling / G alpha (i) signalling events / G alpha (q) signalling events / Amyloid fiber formation / extracellular exosome / extracellular region 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||
 データ登録者 データ登録者 | Rennegarbe M / Liberta F / Fandrich M / Schmidt M | |||||||||
| 資金援助 |  ドイツ, 2件 ドイツ, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2019 ジャーナル: Nat Commun / 年: 2019タイトル: Cryo-EM fibril structures from systemic AA amyloidosis reveal the species complementarity of pathological amyloids. 著者: Falk Liberta / Sarah Loerch / Matthies Rennegarbe / Angelika Schierhorn / Per Westermark / Gunilla T Westermark / Bouke P C Hazenberg / Nikolaus Grigorieff / Marcus Fändrich / Matthias Schmidt /     要旨: Systemic AA amyloidosis is a worldwide occurring protein misfolding disease of humans and animals. It arises from the formation of amyloid fibrils from the acute phase protein serum amyloid A. Here, ...Systemic AA amyloidosis is a worldwide occurring protein misfolding disease of humans and animals. It arises from the formation of amyloid fibrils from the acute phase protein serum amyloid A. Here, we report the purification and electron cryo-microscopy analysis of amyloid fibrils from a mouse and a human patient with systemic AA amyloidosis. The obtained resolutions are 3.0 Å and 2.7 Å for the murine and human fibril, respectively. The two fibrils differ in fundamental properties, such as presence of right-hand or left-hand twisted cross-β sheets and overall fold of the fibril proteins. Yet, both proteins adopt highly similar β-arch conformations within the N-terminal ~21 residues. Our data demonstrate the importance of the fibril protein N-terminus for the stability of the analyzed amyloid fibril morphologies and suggest strategies of combating this disease by interfering with specific fibril polymorphs. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9232.map.gz emd_9232.map.gz | 4.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9232-v30.xml emd-9232-v30.xml emd-9232.xml emd-9232.xml | 16.4 KB 16.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_9232_fsc.xml emd_9232_fsc.xml | 9.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_9232.png emd_9232.png | 185.9 KB | ||
| マスクデータ |  emd_9232_msk_1.map emd_9232_msk_1.map | 75.1 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-9232.cif.gz emd-9232.cif.gz | 5.8 KB | ||
| その他 |  emd_9232_half_map_1.map.gz emd_9232_half_map_1.map.gz emd_9232_half_map_2.map.gz emd_9232_half_map_2.map.gz | 58.3 MB 58.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9232 http://ftp.pdbj.org/pub/emdb/structures/EMD-9232 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9232 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9232 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_9232_validation.pdf.gz emd_9232_validation.pdf.gz | 644.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_9232_full_validation.pdf.gz emd_9232_full_validation.pdf.gz | 643.9 KB | 表示 | |
| XML形式データ |  emd_9232_validation.xml.gz emd_9232_validation.xml.gz | 16.8 KB | 表示 | |
| CIF形式データ |  emd_9232_validation.cif.gz emd_9232_validation.cif.gz | 22.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9232 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9232 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9232 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9232 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6mstMC  8910C  6dsoC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10734 (タイトル: Cryo electron microscopy of ex-vivo human SAA amyloid fibrils EMPIAR-10734 (タイトル: Cryo electron microscopy of ex-vivo human SAA amyloid fibrilsData size: 1.1 TB Data #1: Unaligned multiframe micrographs of ex-vivo human SAA1 [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9232.map.gz / 形式: CCP4 / 大きさ: 75.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9232.map.gz / 形式: CCP4 / 大きさ: 75.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM reconstruction of human Serum Amyloid A fibrils, extracted from diseased human kidney. The fibril shows a helical rise of 2.40 A, a helical twist of 180.79 degree and a resolution of 2.7 A. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.04 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
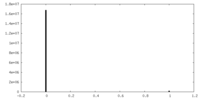
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_9232_msk_1.map emd_9232_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
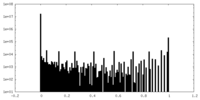
| 密度ヒストグラム |
-ハーフマップ: One of the two independently refined half maps.
| ファイル | emd_9232_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | One of the two independently refined half maps. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
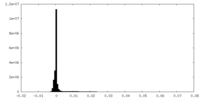
| 密度ヒストグラム |
-ハーフマップ: One of the two independently refined half maps.
| ファイル | emd_9232_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | One of the two independently refined half maps. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
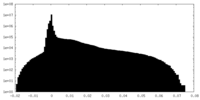
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human AA amyloid fibril
| 全体 | 名称: human AA amyloid fibril |
|---|---|
| 要素 |
|
-超分子 #1: human AA amyloid fibril
| 超分子 | 名称: human AA amyloid fibril / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 器官: kidney Homo sapiens (ヒト) / 器官: kidney |
-分子 #1: Serum amyloid A-1 protein
| 分子 | 名称: Serum amyloid A-1 protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 7.481154 KDa |
| 配列 | 文字列: SFFSFLGEAF DGARDMWRAY SDMREANYIG SDKYFHARGN YDAAKRGPGG VWAAEAISDA RENIQR UniProtKB: Serum amyloid A-1 protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL |
|---|---|
| 緩衝液 | pH: 7 / 構成要素 - 式: ddH2O |
| グリッド | モデル: C-flat-1.2/1.3 4C / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 40 sec. / 前処理 - 雰囲気: OTHER / 前処理 - 気圧: 0.025 kPa / 詳細: 15 mA |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 293 K / 装置: FEI VITROBOT MARK III |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均露光時間: 12.0 sec. / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): -2.5 µm / 最小 デフォーカス(公称値): -0.5 µm / 倍率(公称値): 130000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: AB INITIO MODEL |
|---|---|
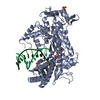
| 得られたモデル |  PDB-6mst: |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)