+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8954 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
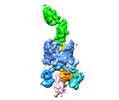
| タイトル | Handover mechanism of the growing pilus by the bacterial outer membrane usher FimD | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | pili / chaperone / usher / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報fimbrial usher porin activity / pilus assembly / pilus tip / mechanosensory behavior / cell adhesion involved in single-species biofilm formation / pilus / cell-substrate adhesion / D-mannose binding / host cell membrane / : ...fimbrial usher porin activity / pilus assembly / pilus tip / mechanosensory behavior / cell adhesion involved in single-species biofilm formation / pilus / cell-substrate adhesion / D-mannose binding / host cell membrane / : / protein folding chaperone / cell outer membrane / cell wall organization / outer membrane-bounded periplasmic space / cell adhesion 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.1 Å | |||||||||
 データ登録者 データ登録者 | Du M / Yuan Z | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2018 ジャーナル: Nature / 年: 2018タイトル: Handover mechanism of the growing pilus by the bacterial outer-membrane usher FimD. 著者: Minge Du / Zuanning Yuan / Hongjun Yu / Nadine Henderson / Samema Sarowar / Gongpu Zhao / Glenn T Werneburg / David G Thanassi / Huilin Li /  要旨: Pathogenic bacteria such as Escherichia coli assemble surface structures termed pili, or fimbriae, to mediate binding to host-cell receptors. Type 1 pili are assembled via the conserved chaperone- ...Pathogenic bacteria such as Escherichia coli assemble surface structures termed pili, or fimbriae, to mediate binding to host-cell receptors. Type 1 pili are assembled via the conserved chaperone-usher pathway. The outer-membrane usher FimD recruits pilus subunits bound by the chaperone FimC via the periplasmic N-terminal domain of the usher. Subunit translocation through the β-barrel channel of the usher occurs at the two C-terminal domains (which we label CTD1 and CTD2) of this protein. How the chaperone-subunit complex bound to the N-terminal domain is handed over to the C-terminal domains, as well as the timing of subunit polymerization into the growing pilus, have previously been unclear. Here we use cryo-electron microscopy to capture a pilus assembly intermediate (FimD-FimC-FimF-FimG-FimH) in a conformation in which FimD is in the process of handing over the chaperone-bound end of the growing pilus to the C-terminal domains. In this structure, FimF has already polymerized with FimG, and the N-terminal domain of FimD swings over to bind CTD2; the N-terminal domain maintains contact with FimC-FimF, while at the same time permitting access to the C-terminal domains. FimD has an intrinsically disordered N-terminal tail that precedes the N-terminal domain. This N-terminal tail folds into a helical motif upon recruiting the FimC-subunit complex, but reorganizes into a loop to bind CTD2 during handover. Because both the N-terminal and C-terminal domains of FimD are bound to the end of the growing pilus, the structure further suggests a mechanism for stabilizing the assembly intermediate to prevent the pilus fibre diffusing away during the incorporation of thousands of subunits. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8954.map.gz emd_8954.map.gz | 4.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8954-v30.xml emd-8954-v30.xml emd-8954.xml emd-8954.xml | 19.3 KB 19.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_8954.png emd_8954.png | 103.7 KB | ||
| Filedesc metadata |  emd-8954.cif.gz emd-8954.cif.gz | 7.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8954 http://ftp.pdbj.org/pub/emdb/structures/EMD-8954 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8954 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8954 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8954.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8954.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.074 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : FimDCFGH tip complex
| 全体 | 名称: FimDCFGH tip complex |
|---|---|
| 要素 |
|
-超分子 #1: FimDCFGH tip complex
| 超分子 | 名称: FimDCFGH tip complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 180 KDa |
-分子 #1: Chaperone protein FimC
| 分子 | 名称: Chaperone protein FimC / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 26.716869 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSNKNVNVRK SQEITFCLLA GILMFMAMMV AGRAEAGVAL GATRVIYPAG QKQEQLAVTN NDENSTYLIQ SWVENADGVK DGRFIVTPP LFAMKGKKEN TLRILDATNN QLPQDRESLF WMNVKAIPSM DKSKLTENTL QLAIISRIKL YYRPAKLALP P DQAAEKLR ...文字列: MSNKNVNVRK SQEITFCLLA GILMFMAMMV AGRAEAGVAL GATRVIYPAG QKQEQLAVTN NDENSTYLIQ SWVENADGVK DGRFIVTPP LFAMKGKKEN TLRILDATNN QLPQDRESLF WMNVKAIPSM DKSKLTENTL QLAIISRIKL YYRPAKLALP P DQAAEKLR FRRSANSLTL INPTPYYLTV TELNAGTRVL ENALVPPMGE STVKLPSDAG SNITYRTIND YGALTPKMTG VM E UniProtKB: Chaperone protein FimC |
-分子 #2: Fimbrial biogenesis outer membrane usher protein
| 分子 | 名称: Fimbrial biogenesis outer membrane usher protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 96.705109 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSYLNLRLYQ RNTQCLHIRK HRLAGFFVRL FVACAFAAQA SLSSAELYFN PRFLADDPQA VADLSRFENG QELPPGTYRV DIYLNNGYM ATRDVTFNTG DSEQGIVPCL TRAQLASMGL NTASVAGMNL LADDACVPLT TMVQDATAHL DVGQQRLNLT I PQAFMSNR ...文字列: MSYLNLRLYQ RNTQCLHIRK HRLAGFFVRL FVACAFAAQA SLSSAELYFN PRFLADDPQA VADLSRFENG QELPPGTYRV DIYLNNGYM ATRDVTFNTG DSEQGIVPCL TRAQLASMGL NTASVAGMNL LADDACVPLT TMVQDATAHL DVGQQRLNLT I PQAFMSNR ARGYIPPELW DPGINAGLLN YNFSGNSVQN RIGGNSHYAY LNLQSGLNIG AWRLRDNTTW SYNSSDRSSG SK NKWQHIN TWLERDIIPL RSRLTLGDGY TQGDIFDGIN FRGAQLASDD NMLPDSQRGF APVIHGIARG TAQVTIKQNG YDI YNSTVP PGPFTINDIY AAGNSGDLQV TIKEADGSTQ IFTVPYSSVP LLQREGHTRY SITAGEYRSG NAQQEKPRFF QSTL LHGLP AGWTIYGGTQ LADRYRAFNF GIGKNMGALG ALSVDMTQAN STLPDDSQHD GQSVRFLYNK SLNESGTNIQ LVGYR YSTS GYFNFADTTY SRMNGYNIET QDGVIQVKPK FTDYYNLAYN KRGKLQLTVT QQLGRTSTLY LSGSHQTYWG TSNVDE QFQ AGLNTAFEDI NWTLSYSLTK NAWQKGRDQM LALNVNIPFS HWLRSDSKSQ WRHASASYSM SHDLNGRMTN LAGVYGT LL EDNNLSYSVQ TGYAGGGDGN SGSTGYATLN YRGGYGNANI GYSHSDDIKQ LYYGVSGGVL AHANGVTLGQ PLNDTVVL V KAPGAKDAKV ENQTGVRTDW RGYAVLPYAT EYRENRVALD TNTLADNVDL DNAVANVVPT RGAIVRAEFK ARVGIKLLM TLTHNNKPLP FGAMVTSESS QSSGIVADNG QVYLSGMPLA GKVQVKWGEE ENAHCVANYQ LPPESQQQLL TQLSAECRS UniProtKB: Fimbrial biogenesis outer membrane usher protein |
-分子 #3: Protein FimF
| 分子 | 名称: Protein FimF / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 16.379371 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAADSTITIR GYVRDNGCSV AAESTNFTVD LMENAAKQFN NIGATTPVVP FRILLSPCGN AVSAVKVGFT GVADSHNANL LALENTVSA ASGLGIQLLN EQQNQIPLNA PSSALSWTTL TPGKPNTLNF YARLMATQVP VTAGHINATA TFTLEYQ UniProtKB: Protein FimF |
-分子 #4: Protein FimG
| 分子 | 名称: Protein FimG / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 16.190834 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAAILALASA TIQAADVTIT VNGKVVAKPC TVSTTNATVD LGDLYSFSLM SAGAASAWHD VALELTNCPV GTSRVTASFS GAADSTGYY KNQGTAQNIQ LELQDDSGNT LNTGATKTVQ VDDSSQSAHF PLQVRALTVN GGATQGTIQA VISITYTYS UniProtKB: Protein FimG |
-分子 #5: Type 1 fimbrin D-mannose specific adhesin
| 分子 | 名称: Type 1 fimbrin D-mannose specific adhesin / タイプ: protein_or_peptide / ID: 5 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 31.48826 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKRVITLFAV LLMGWSVNAW SFACKTANGT AIPIGGGSAN VYVNLAPVVN VGQNLVVDLS TQIFCHNDYP ETITDYVTLQ RGSAYGGVL SNFSGTVKYS GSSYPFPTTS ETPRVVYNSR TDKPWPVALY LTPVSSAGGV AIKAGSLIAV LILRQTNNYN S DDFQFVWN ...文字列: MKRVITLFAV LLMGWSVNAW SFACKTANGT AIPIGGGSAN VYVNLAPVVN VGQNLVVDLS TQIFCHNDYP ETITDYVTLQ RGSAYGGVL SNFSGTVKYS GSSYPFPTTS ETPRVVYNSR TDKPWPVALY LTPVSSAGGV AIKAGSLIAV LILRQTNNYN S DDFQFVWN IYANNDVVVP TGGCDVSARD VTVTLPDYPG SVPIPLTVYC AKSQNLGYYL SGTTADAGNS IFTNTASFSP AQ GVGVQLT RNGTIIPANN TVSLGAVGTS AVSLGLTANY ARTGGQVTAG NVQSIIGVTF VYQ UniProtKB: Type 1 fimbrin D-mannose specific adhesin |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















