登録情報 データベース : EMDB / ID : EMD-8215タイトル Single particle cryo-EM structure of the voltage-gated K+ channel Eag1 bound to the channel inhibitor calmodulin Voltage-gated K+ channel Eag1 bound to the channel inhibitor calmodulin 細胞器官・細胞要素 : Voltage-gated K+ channel Eag1 bound to the channel inhibitor calmodulin細胞器官・細胞要素 : Voltage-gated potassium channel Eag1タンパク質・ペプチド : Potassium voltage-gated channel subfamily H member 1細胞器官・細胞要素 : Calmodulinリガンド : 2-acetamido-2-deoxy-beta-D-glucopyranoseリガンド : CHOLESTEROL HEMISUCCINATE / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Rattus norvegicus (ドブネズミ) / Homo sapiens (ヒト)手法 / / 解像度 : 3.78 Å Whicher JR / MacKinnon R 資金援助 Organization Grant number 国 National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) GM43949 Howard Hughes Medical Institute (HHMI) Damon Runyon Cancer Research Foundation DRG-2212-15
ジャーナル : Science / 年 : 2016タイトル : Structure of the voltage-gated K⁺ channel Eag1 reveals an alternative voltage sensing mechanism.著者 : Jonathan R Whicher / Roderick MacKinnon / 要旨 : Voltage-gated potassium (K(v)) channels are gated by the movement of the transmembrane voltage sensor, which is coupled, through the helical S4-S5 linker, to the potassium pore. We determined the ... Voltage-gated potassium (K(v)) channels are gated by the movement of the transmembrane voltage sensor, which is coupled, through the helical S4-S5 linker, to the potassium pore. We determined the single-particle cryo-electron microscopy structure of mammalian K(v)10.1, or Eag1, bound to the channel inhibitor calmodulin, at 3.78 angstrom resolution. Unlike previous K(v) structures, the S4-S5 linker of Eag1 is a five-residue loop and the transmembrane segments are not domain swapped, which suggest an alternative mechanism of voltage-dependent gating. Additionally, the structure and position of the S4-S5 linker allow calmodulin to bind to the intracellular domains and to close the potassium pore, independent of voltage-sensor position. The structure reveals an alternative gating mechanism for K(v) channels and provides a template to further understand the gating properties of Eag1 and related channels. 履歴 登録 2016年6月16日 - ヘッダ(付随情報) 公開 2016年8月17日 - マップ公開 2016年8月17日 - 更新 2024年10月23日 - 現状 2024年10月23日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
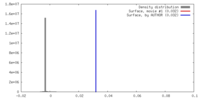
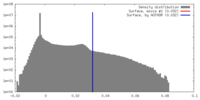
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 米国, 3件
米国, 3件  引用
引用 ジャーナル: Science / 年: 2016
ジャーナル: Science / 年: 2016
 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_8215.map.gz
emd_8215.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-8215-v30.xml
emd-8215-v30.xml emd-8215.xml
emd-8215.xml EMDBヘッダ
EMDBヘッダ emd_8215_fsc.xml
emd_8215_fsc.xml FSCデータファイル
FSCデータファイル emd_8215.png
emd_8215.png emd-8215.cif.gz
emd-8215.cif.gz emd_8215_additional_1.map.gz
emd_8215_additional_1.map.gz emd_8215_additional_2.map.gz
emd_8215_additional_2.map.gz emd_8215_additional_3.map.gz
emd_8215_additional_3.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-8215
http://ftp.pdbj.org/pub/emdb/structures/EMD-8215 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8215
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8215 emd_8215_validation.pdf.gz
emd_8215_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_8215_full_validation.pdf.gz
emd_8215_full_validation.pdf.gz emd_8215_validation.xml.gz
emd_8215_validation.xml.gz emd_8215_validation.cif.gz
emd_8215_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8215
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8215 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8215
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8215 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_8215.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_8215.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)

 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析
 ムービー
ムービー コントローラー
コントローラー







































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)