+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6493 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Electron cryo-microscopy of bacteriophage EL chaperonin in the ADP-bound conformation | |||||||||
 マップデータ マップデータ | Reconstruction of the bacteriophage phi EL ADP-bound chaperonin conformation | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | chaperonin / phi-EL / protein folding / ADP conformation | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP-dependent protein folding chaperone / protein refolding / ATP binding / metal ion binding / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Pseudomonas phage EL (ファージ) Pseudomonas phage EL (ファージ) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 11.7 Å | |||||||||
 データ登録者 データ登録者 | Molugu SK / Hildenbrand ZL / Morgan DG / Sherman MB / He L / Georgopoulos C / Sernova NV / Kurochkina LP / Mesyanzhinov VV / Miroshnikov KA / Bernal RA | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2016 ジャーナル: Structure / 年: 2016タイトル: Ring Separation Highlights the Protein-Folding Mechanism Used by the Phage EL-Encoded Chaperonin. 著者: Sudheer K Molugu / Zacariah L Hildenbrand / David Gene Morgan / Michael B Sherman / Lilin He / Costa Georgopoulos / Natalia V Sernova / Lidia P Kurochkina / Vadim V Mesyanzhinov / Konstantin ...著者: Sudheer K Molugu / Zacariah L Hildenbrand / David Gene Morgan / Michael B Sherman / Lilin He / Costa Georgopoulos / Natalia V Sernova / Lidia P Kurochkina / Vadim V Mesyanzhinov / Konstantin A Miroshnikov / Ricardo A Bernal /   要旨: Chaperonins are ubiquitous, ATP-dependent protein-folding molecular machines that are essential for all forms of life. Bacteriophage φEL encodes its own chaperonin to presumably fold exceedingly ...Chaperonins are ubiquitous, ATP-dependent protein-folding molecular machines that are essential for all forms of life. Bacteriophage φEL encodes its own chaperonin to presumably fold exceedingly large viral proteins via profoundly different nucleotide-binding conformations. Our structural investigations indicate that ATP likely binds to both rings simultaneously and that a misfolded substrate acts as the trigger for ATP hydrolysis. More importantly, the φEL complex dissociates into two single rings resulting from an evolutionarily altered residue in the highly conserved ATP-binding pocket. Conformational changes also more than double the volume of the single-ring internal chamber such that larger viral proteins are accommodated. This is illustrated by the fact that φEL is capable of folding β-galactosidase, a 116-kDa protein. Collectively, the architecture and protein-folding mechanism of the φEL chaperonin are significantly different from those observed in group I and II chaperonins. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6493.map.gz emd_6493.map.gz | 14.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6493-v30.xml emd-6493-v30.xml emd-6493.xml emd-6493.xml | 10.4 KB 10.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_6493.jpg emd_6493.jpg | 96.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6493 http://ftp.pdbj.org/pub/emdb/structures/EMD-6493 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6493 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6493 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6493_validation.pdf.gz emd_6493_validation.pdf.gz | 79.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6493_full_validation.pdf.gz emd_6493_full_validation.pdf.gz | 78.4 KB | 表示 | |
| XML形式データ |  emd_6493_validation.xml.gz emd_6493_validation.xml.gz | 494 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6493 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6493 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6493 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6493 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6493.map.gz / 形式: CCP4 / 大きさ: 15.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6493.map.gz / 形式: CCP4 / 大きさ: 15.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
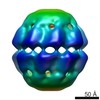
| 注釈 | Reconstruction of the bacteriophage phi EL ADP-bound chaperonin conformation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.17 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
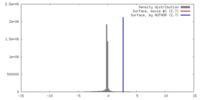
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Bacteriphage phi-EL encoded chaperonin in the ADP-bound conformation
| 全体 | 名称: Bacteriphage phi-EL encoded chaperonin in the ADP-bound conformation |
|---|---|
| 要素 |
|
-超分子 #1000: Bacteriphage phi-EL encoded chaperonin in the ADP-bound conformation
| 超分子 | 名称: Bacteriphage phi-EL encoded chaperonin in the ADP-bound conformation タイプ: sample / ID: 1000 / 集合状態: homoheptamer / Number unique components: 1 |
|---|---|
| 分子量 | 理論値: 431.7677 KDa |
-分子 #1: phi-EL chaperonin
| 分子 | 名称: phi-EL chaperonin / タイプ: protein_or_peptide / ID: 1 / コピー数: 7 / 集合状態: heptamer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Pseudomonas phage EL (ファージ) / 別称: Bacteriophage EL Pseudomonas phage EL (ファージ) / 別称: Bacteriophage EL |
| 分子量 | 理論値: 61.6811 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: Putative GroEL-like chaperonine protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 詳細: 50 mM HEPES, pH 7.5, 150 mM NaCl, 2 mM ADP, 2 mM EDTA |
| グリッド | 詳細: Quantifoil R2/2 grids glow-discharged in air for 1 minute |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 80 % / チャンバー内温度: 100 K / 装置: HOMEMADE PLUNGER / 手法: Blot for 2-3 seconds before plunging |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 3200FS |
|---|---|
| 温度 | 最低: 88 K / 最高: 103 K / 平均: 100 K |
| 日付 | 2009年8月1日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) デジタル化 - サンプリング間隔: 12 µm / 実像数: 50 / 平均電子線量: 10 e/Å2 / ビット/ピクセル: 8 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 69000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: GATAN LIQUID NITROGEN |
- 画像解析
画像解析
| CTF補正 | 詳細: Each particle |
|---|---|
| 最終 再構成 | アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 11.7 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: EMAN, EMAN2, RELION / 使用した粒子像数: 18778 |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)