+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of P-Glycoprotein in inward facing 1 state under continuous turnover conditions with verapamil | |||||||||
 マップデータ マップデータ | CryoEM structure of P-Glycoprotein in inward facing 1 state under continuous turnover conditions with verapamil | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | multidrug resistance / ABC transporter / membrane protein / transporter / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報carboxylic acid transmembrane transport / carboxylic acid transmembrane transporter activity / hormone transport / cellular response to nonylphenol / cellular response to borneol / response to codeine / response to cyclosporin A / cellular response to mycotoxin / daunorubicin transport / positive regulation of response to drug ...carboxylic acid transmembrane transport / carboxylic acid transmembrane transporter activity / hormone transport / cellular response to nonylphenol / cellular response to borneol / response to codeine / response to cyclosporin A / cellular response to mycotoxin / daunorubicin transport / positive regulation of response to drug / terpenoid transport / ceramide floppase activity / negative regulation of sensory perception of pain / positive regulation of establishment of Sertoli cell barrier / regulation of intestinal absorption / cellular response to external biotic stimulus / response to quercetin / response to antineoplastic agent / ceramide translocation / floppase activity / Abacavir transmembrane transport / establishment of blood-retinal barrier / phosphatidylethanolamine flippase activity / protein localization to bicellular tight junction / phosphatidylcholine floppase activity / external side of apical plasma membrane / Atorvastatin ADME / xenobiotic transport across blood-brain barrier / response to thyroxine / establishment of blood-brain barrier / transepithelial transport / xenobiotic detoxification by transmembrane export across the plasma membrane / export across plasma membrane / P-type phospholipid transporter / cellular response to L-glutamate / response to vitamin A / ABC-type xenobiotic transporter / response to vitamin D / response to glycoside / response to alcohol / response to glucagon / intestinal absorption / ABC-type xenobiotic transporter activity / Prednisone ADME / cellular response to antibiotic / phospholipid translocation / cellular hyperosmotic salinity response / maintenance of blood-brain barrier / cellular response to alkaloid / efflux transmembrane transporter activity / transmembrane transporter activity / xenobiotic transmembrane transporter activity / ATPase-coupled transmembrane transporter activity / cellular response to dexamethasone stimulus / response to cadmium ion / transport across blood-brain barrier / lactation / xenobiotic metabolic process / regulation of chloride transport / response to progesterone / placenta development / stem cell proliferation / cellular response to estradiol stimulus / brush border membrane / female pregnancy / circadian rhythm / ABC-family proteins mediated transport / transmembrane transport / G2/M transition of mitotic cell cycle / cellular response to tumor necrosis factor / cellular response to lipopolysaccharide / response to hypoxia / apical plasma membrane / response to xenobiotic stimulus / ubiquitin protein ligase binding / cell surface / ATP hydrolysis activity / extracellular exosome / ATP binding / membrane / plasma membrane / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.0 Å | |||||||||
 データ登録者 データ登録者 | Culbertson A / Liao M | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2025 ジャーナル: Nat Commun / 年: 2025タイトル: Cryo-EM of human P-glycoprotein reveals an intermediate occluded conformation during active drug transport. 著者: Alan T Culbertson / Maofu Liao /   要旨: P-glycoprotein (Pgp) is an important human multidrug transporter that contributes to pharmacokinetics and multidrug resistance. Despite decades of study, the conformation transition cycle of Pgp ...P-glycoprotein (Pgp) is an important human multidrug transporter that contributes to pharmacokinetics and multidrug resistance. Despite decades of study, the conformation transition cycle of Pgp undergoing active drug transport is not defined, thus the precise relevance of all available Pgp structures to uninterrupted multidrug transport remains unclear. Here, we use cryo-EM of membrane-embedded human Pgp under continuous turnover conditions to analyze the conformational ensembles of Pgp transporting distinct substrates. These results delineate multiple conformations including inward-facing and closed conformations, highlighting the occluded conformation as a critical intermediate state between transporter closure and substrate release. A combination of structural, functional, and computational studies reveals the transmembrane helices 4 and 10 undergoing drastic rearrangement to coordinate substrate binding, occlusion, and release, and identifies a peripheral site involved in substrate capture and Pgp inhibition. Together, our results provide a set of snapshots of Pgp undergoing continuous drug transport, unveiling the intricate interplay between transporter dynamics and drug movement, and shed light on the mechanism of polyspecificity. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_40292.map.gz emd_40292.map.gz | 24.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-40292-v30.xml emd-40292-v30.xml emd-40292.xml emd-40292.xml | 19 KB 19 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_40292.png emd_40292.png | 78.9 KB | ||
| Filedesc metadata |  emd-40292.cif.gz emd-40292.cif.gz | 6.7 KB | ||
| その他 |  emd_40292_half_map_1.map.gz emd_40292_half_map_1.map.gz emd_40292_half_map_2.map.gz emd_40292_half_map_2.map.gz | 20.6 MB 20.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-40292 http://ftp.pdbj.org/pub/emdb/structures/EMD-40292 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40292 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40292 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_40292_validation.pdf.gz emd_40292_validation.pdf.gz | 942.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_40292_full_validation.pdf.gz emd_40292_full_validation.pdf.gz | 941.6 KB | 表示 | |
| XML形式データ |  emd_40292_validation.xml.gz emd_40292_validation.xml.gz | 10.4 KB | 表示 | |
| CIF形式データ |  emd_40292_validation.cif.gz emd_40292_validation.cif.gz | 12.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40292 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40292 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40292 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40292 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8sb7MC  8gmgC  8gmjC  8sa0C  8sa1C  8sb8C  8sb9C  8sbaC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_40292.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_40292.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of P-Glycoprotein in inward facing 1 state under continuous turnover conditions with verapamil | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: CryoEM structure of P-Glycoprotein in inward facing 1...
| ファイル | emd_40292_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of P-Glycoprotein in inward facing 1 state under continuous turnover conditions with verapamil | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: CryoEM structure of P-Glycoprotein in inward facing 1...
| ファイル | emd_40292_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of P-Glycoprotein in inward facing 1 state under continuous turnover conditions with verapamil | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : CryoEM structure of P-Glycoprotein in inward facing 1 state under...
| 全体 | 名称: CryoEM structure of P-Glycoprotein in inward facing 1 state under continuous turnover conditions with verapamil |
|---|---|
| 要素 |
|
-超分子 #1: CryoEM structure of P-Glycoprotein in inward facing 1 state under...
| 超分子 | 名称: CryoEM structure of P-Glycoprotein in inward facing 1 state under continuous turnover conditions with verapamil タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: ATP-dependent translocase ABCB1
| 分子 | 名称: ATP-dependent translocase ABCB1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: ABC-type xenobiotic transporter |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 141.644781 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MDLEGDRNGG AKKKNFFKLN NKSEKDKKEK KPTVSVFSMF RYSNWLDKLY MVVGTLAAII HGAGLPLMML VFGEMTDIFA NAGNLEDLM SNITNRSDIN DTGFFMNLEE DMTRYAYYYS GIGAGVLVAA YIQVSFWCLA AGRQIHKIRK QFFHAIMRQE I GWFDVHDV ...文字列: MDLEGDRNGG AKKKNFFKLN NKSEKDKKEK KPTVSVFSMF RYSNWLDKLY MVVGTLAAII HGAGLPLMML VFGEMTDIFA NAGNLEDLM SNITNRSDIN DTGFFMNLEE DMTRYAYYYS GIGAGVLVAA YIQVSFWCLA AGRQIHKIRK QFFHAIMRQE I GWFDVHDV GELNTRLTDD VSKINEGIGD KIGMFFQSMA TFFTGFIVGF TRGWKLTLVI LAISPVLGLS AAVWAKILSS FT DKELLAY AKAGAVAEEV LAAIRTVIAF GGQKKELERY NKNLEEAKRI GIKKAITANI SIGAAFLLIY ASYALAFWYG TTL VLSGEY SIGQVLTVFF SVLIGAFSVG QASPSIEAFA NARGAAYEIF KIIDNKPSID SYSKSGHKPD NIKGNLEFRN VHFS YPSRK EVKILKGLNL KVQSGQTVAL VGNSGCGKST TVQLMQRLYD PTEGMVSVDG QDIRTINVRF LREIIGVVSQ EPVLF ATTI AENIRYGREN VTMDEIEKAV KEANAYDFIM KLPHKFDTLV GERGAQLSGG QKQRIAIARA LVRNPKILLL DEATSA LDT ESEAVVQVAL DKARKGRTTI VIAHRLSTVR NADVIAGFDD GVIVEKGNHD ELMKEKGIYF KLVTMQTAGN EVELENA AD ESKSEIDALE MSSNDSRSSL IRKRSTRRSV RGSQAQDRKL STKEALDESI PPVSFWRIMK LNLTEWPYFV VGVFCAII N GGLQPAFAII FSKIIGVFTR IDDPETKRQN SNLFSLLFLA LGIISFITFF LQGFTFGKAG EILTKRLRYM VFRSMLRQD VSWFDDPKNT TGALTTRLAN DAAQVKGAIG SRLAVITQNI ANLGTGIIIS FIYGWQLTLL LLAIVPIIAI AGVVEMKMLS GQALKDKKE LEGSGKIATE AIENFRTVVS LTQEQKFEHM YAQSLQVPYR NSLRKAHIFG ITFSFTQAMM YFSYAGCFRF G AYLVAHKL MSFEDVLLVF SAVVFGAMAV GQVSSFAPDY AKAKISAAHI IMIIEKTPLI DSYSTEGLMP NTLEGNVTFG EV VFNYPTR PDIPVLQGLS LEVKKGQTLA LVGSSGCGKS TVVQLLERFY DPLAGKVLLD GKEIKRLNVQ WLRAHLGIVS QEP ILFDCS IAENIAYGDN SRVVSQEEIV RAAKEANIHA FIESLPNKYS TKVGDKGTQL SGGQKQRIAI ARALVRQPHI LLLD EATSA LDTESEKVVQ EALDKAREGR TCIVIAHRLS TIQNADLIVV FQNGRVKEHG THQQLLAQKG IYFSMVSVQA GTKRQ UniProtKB: ATP-dependent translocase ABCB1 |
-分子 #2: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 2 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-分子 #3: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 3 / コピー数: 2 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #4: Dexverapamil
| 分子 | 名称: Dexverapamil / タイプ: ligand / ID: 4 / コピー数: 1 / 式: I6H |
|---|---|
| 分子量 | 理論値: 454.602 Da |
| Chemical component information | 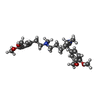 ChemComp-I6H: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 2 / 実像数: 11891 / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




































