+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3809 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The Cryo-Electron Microscopy Structure of the Type 1 Chaperone-Usher Pilus Rod | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | bacterial pilus / chaperone-usher pilus / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cell adhesion involved in single-species biofilm formation / pilus / cell adhesion / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 4.2 Å | |||||||||
 データ登録者 データ登録者 | Hospenthal MK / Costa TRD / Redzej A / Waksman G | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2017 ジャーナル: Structure / 年: 2017タイトル: The Cryoelectron Microscopy Structure of the Type 1 Chaperone-Usher Pilus Rod. 著者: Manuela K Hospenthal / Dawid Zyla / Tiago R D Costa / Adam Redzej / Christoph Giese / James Lillington / Rudi Glockshuber / Gabriel Waksman /   要旨: Adhesive chaperone-usher pili are long, supramolecular protein fibers displayed on the surface of many bacterial pathogens. The type 1 and P pili of uropathogenic Escherichia coli (UPEC) play ...Adhesive chaperone-usher pili are long, supramolecular protein fibers displayed on the surface of many bacterial pathogens. The type 1 and P pili of uropathogenic Escherichia coli (UPEC) play important roles during urinary tract colonization, mediating attachment to the bladder and kidney, respectively. The biomechanical properties of the helical pilus rods allow them to reversibly uncoil in response to flow-induced forces, allowing UPEC to retain a foothold in the unique and hostile environment of the urinary tract. Here we provide the 4.2-Å resolution cryo-EM structure of the type 1 pilus rod, which together with the previous P pilus rod structure rationalizes the remarkable "spring-like" properties of chaperone-usher pili. The cryo-EM structure of the type 1 pilus rod differs in its helical parameters from the structure determined previously by a hybrid approach. We provide evidence that these structural differences originate from different quaternary structures of pili assembled in vivo and in vitro. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3809.map.gz emd_3809.map.gz | 3.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3809-v30.xml emd-3809-v30.xml emd-3809.xml emd-3809.xml | 11.8 KB 11.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_3809.png emd_3809.png | 273.9 KB | ||
| マスクデータ |  emd_3809_msk_1.map emd_3809_msk_1.map | 52.7 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-3809.cif.gz emd-3809.cif.gz | 5.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3809 http://ftp.pdbj.org/pub/emdb/structures/EMD-3809 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3809 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3809 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_3809_validation.pdf.gz emd_3809_validation.pdf.gz | 388.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_3809_full_validation.pdf.gz emd_3809_full_validation.pdf.gz | 387.8 KB | 表示 | |
| XML形式データ |  emd_3809_validation.xml.gz emd_3809_validation.xml.gz | 6.1 KB | 表示 | |
| CIF形式データ |  emd_3809_validation.cif.gz emd_3809_validation.cif.gz | 6.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3809 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3809 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3809 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3809 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3809.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3809.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.13 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
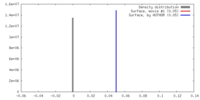
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_3809_msk_1.map emd_3809_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
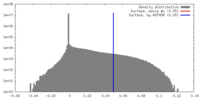
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Type 1 Chaperone-usher pilus
| 全体 | 名称: Type 1 Chaperone-usher pilus |
|---|---|
| 要素 |
|
-超分子 #1: Type 1 Chaperone-usher pilus
| 超分子 | 名称: Type 1 Chaperone-usher pilus / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all / 詳細: Superhelical assembly of the pilus rod subunit FimA |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Type-1 fimbrial protein, A chain
| 分子 | 名称: Type-1 fimbrial protein, A chain / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 15.835243 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: AATTVNGGTV HFKGEVVNAA CAVDAGSVDQ TVQLGQVRTA SLAQEGATSS AVGFNIQLND CDTNVASKAA VAFLGTAIDA GHTNVLALQ SSAAGSATNV GVQILDRTGA ALTLDGATFS SETTLNNGTN TIPFQARYFA TGAATPGAAN ADATFKVQYQ UniProtKB: Type-1 fimbrial protein, A chain |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 / 構成要素:
| ||||||
|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil 1.2/1.3 400 mesh grid / 前処理 - タイプ: GLOW DISCHARGE | ||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 1.7 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 8.01188 Å 想定した対称性 - らせんパラメータ - ΔΦ: 114.992 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 4.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 2.0) / 使用した粒子像数: 115510 |
|---|---|
| Segment selection | 選択した数: 115545 / ソフトウェア - 名称: RELION (ver. 2.0) |
| 初期モデル | モデルのタイプ: OTHER / 詳細: solid cylinder (diameter 100 Angstrom) |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
-原子モデル構築 1
| 初期モデル |
| ||||||
|---|---|---|---|---|---|---|---|
| 得られたモデル |  PDB-5oh0: |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)