+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-31440 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human TMEM120A in the CoASH-bound state | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Human / membrane protein / COA | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報coenzyme A binding / protein heterooligomerization / nuclear inner membrane / fat cell differentiation / monoatomic ion channel activity / detection of mechanical stimulus involved in sensory perception of pain / antiviral innate immune response / protein homooligomerization / monoatomic ion transmembrane transport / endoplasmic reticulum ...coenzyme A binding / protein heterooligomerization / nuclear inner membrane / fat cell differentiation / monoatomic ion channel activity / detection of mechanical stimulus involved in sensory perception of pain / antiviral innate immune response / protein homooligomerization / monoatomic ion transmembrane transport / endoplasmic reticulum / membrane / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
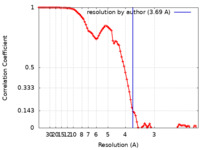
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.69 Å | ||||||||||||
 データ登録者 データ登録者 | Song DF / Rong Y | ||||||||||||
| 資金援助 |  中国, 3件 中国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2021 ジャーナル: Elife / 年: 2021タイトル: TMEM120A contains a specific coenzyme A-binding site and might not mediate poking- or stretch-induced channel activities in cells. 著者: Yao Rong / Jinghui Jiang / Yiwei Gao / Jianli Guo / Danfeng Song / Wenhao Liu / Mingmin Zhang / Yan Zhao / Bailong Xiao / Zhenfeng Liu /  要旨: TMEM120A, a member of the transmembrane protein 120 (TMEM120) family, has a pivotal function in adipocyte differentiation and metabolism, and may also contribute to sensing mechanical pain by ...TMEM120A, a member of the transmembrane protein 120 (TMEM120) family, has a pivotal function in adipocyte differentiation and metabolism, and may also contribute to sensing mechanical pain by functioning as an ion channel named TACAN. Here we report that expression of TMEM120A is not sufficient in mediating poking- or stretch-induced currents in cells and have solved cryo-electron microscopy (cryo-EM) structures of human TMEM120A (TMEM120A) in complex with an endogenous metabolic cofactor (coenzyme A, CoASH) and in the apo form. TMEM120A forms a symmetrical homodimer with each monomer containing an amino-terminal coiled-coil motif followed by a transmembrane domain with six membrane-spanning helices. Within the transmembrane domain, a CoASH molecule is hosted in a deep cavity and forms specific interactions with nearby amino acid residues. Mutation of a central tryptophan residue involved in binding CoASH dramatically reduced the binding affinity of TMEM120A with CoASH. TMEM120A exhibits distinct conformations at the states with or without CoASH bound. Our results suggest that TMEM120A may have alternative functional roles potentially involved in CoASH transport, sensing, or metabolism. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_31440.map.gz emd_31440.map.gz | 59.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-31440-v30.xml emd-31440-v30.xml emd-31440.xml emd-31440.xml | 13.8 KB 13.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_31440_fsc.xml emd_31440_fsc.xml | 8.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_31440.png emd_31440.png | 85.1 KB | ||
| Filedesc metadata |  emd-31440.cif.gz emd-31440.cif.gz | 5.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-31440 http://ftp.pdbj.org/pub/emdb/structures/EMD-31440 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-31440 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-31440 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_31440_validation.pdf.gz emd_31440_validation.pdf.gz | 475.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_31440_full_validation.pdf.gz emd_31440_full_validation.pdf.gz | 474.7 KB | 表示 | |
| XML形式データ |  emd_31440_validation.xml.gz emd_31440_validation.xml.gz | 11 KB | 表示 | |
| CIF形式データ |  emd_31440_validation.cif.gz emd_31440_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-31440 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-31440 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-31440 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-31440 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_31440.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_31440.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.07 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : transmembrane protein 120A
| 全体 | 名称: transmembrane protein 120A |
|---|---|
| 要素 |
|
-超分子 #1: transmembrane protein 120A
| 超分子 | 名称: transmembrane protein 120A / タイプ: cell / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Transmembrane protein 120A
| 分子 | 名称: Transmembrane protein 120A / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 44.843578 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDYKDDDDKW SHPQFEKHHH HHHHHWSHPQ FEKQPPPPGP LGDCLRDWED LQQDFQNIQE THRLYRLKLE ELTKLQNNCT SSITRQKKR LQELALALKK CKPSLPAEAE GAAQELENQM KERQGLFFDM EAYLPKKNGL YLSLVLGNVN VTLLSKQAKF A YKDEYEKF ...文字列: MDYKDDDDKW SHPQFEKHHH HHHHHWSHPQ FEKQPPPPGP LGDCLRDWED LQQDFQNIQE THRLYRLKLE ELTKLQNNCT SSITRQKKR LQELALALKK CKPSLPAEAE GAAQELENQM KERQGLFFDM EAYLPKKNGL YLSLVLGNVN VTLLSKQAKF A YKDEYEKF KLYLTIILIL ISFTCRFLLN SRVTDAAFNF LLVWYYCTLT IRESILINNG SRIKGWWVFH HYVSTFLSGV ML TWPDGLM YQKFRNQFLS FSMYQSFVQF LQYYYQSGCL YRLRALGERH TMDLTVEGFQ SWMWRGLTFL LPFLFFGHFW QLF NALTLF NLAQDPQCKE WQVLMCGFPF LLLFLGNFFT TLRVVHHKFH SQRHGSKKD UniProtKB: Transmembrane protein 120A |
-分子 #2: COENZYME A
| 分子 | 名称: COENZYME A / タイプ: ligand / ID: 2 / コピー数: 2 / 式: COA |
|---|---|
| 分子量 | 理論値: 767.534 Da |
| Chemical component information |  ChemComp-COA: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: OTHER | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV | ||||||||||||
| 詳細 | The protein is reconstituted in lipid nanodiscs |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 2 / 実像数: 8148 / 平均露光時間: 1.875 sec. / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 当てはまり具合の基準: Correlation coefficient |
|---|---|
| 得られたモデル |  PDB-7f3t: |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)