+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | LBD conformation 1 (LBDconf1) of GluA2 flip Q isoform of AMPA receptor in complex with gain-of-function TARP gamma2, with 10mM CaCl2, 140mM NMDG, 330uM CTZ, and 100mM L-glutamate (Open-Ca10) | |||||||||
 マップデータ マップデータ | LBDconf1, Open-Ca10 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Inotropic glutamate receptors / AMPA receptors / ligand gated ion channel / auxiliary subunit / TARP / stargazin / TARP gamma2 / glutamate / calcium / neurotransmitter receptor / synaptic transmission / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報spine synapse / dendritic spine neck / dendritic spine head / cellular response to amine stimulus / Activation of AMPA receptors / perisynaptic space / ligand-gated monoatomic cation channel activity / AMPA glutamate receptor activity / Trafficking of GluR2-containing AMPA receptors / response to lithium ion ...spine synapse / dendritic spine neck / dendritic spine head / cellular response to amine stimulus / Activation of AMPA receptors / perisynaptic space / ligand-gated monoatomic cation channel activity / AMPA glutamate receptor activity / Trafficking of GluR2-containing AMPA receptors / response to lithium ion / kainate selective glutamate receptor activity / AMPA glutamate receptor complex / cellular response to glycine / extracellularly glutamate-gated ion channel activity / ionotropic glutamate receptor complex / immunoglobulin binding / asymmetric synapse / conditioned place preference / regulation of receptor recycling / glutamate receptor binding / Unblocking of NMDA receptors, glutamate binding and activation / positive regulation of synaptic transmission / regulation of synaptic transmission, glutamatergic / response to fungicide / glutamate-gated receptor activity / cytoskeletal protein binding / regulation of long-term synaptic depression / extracellular ligand-gated monoatomic ion channel activity / cellular response to brain-derived neurotrophic factor stimulus / glutamate-gated calcium ion channel activity / presynaptic active zone membrane / somatodendritic compartment / ionotropic glutamate receptor binding / dendrite membrane / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / dendrite cytoplasm / ionotropic glutamate receptor signaling pathway / synaptic membrane / SNARE binding / dendritic shaft / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / synaptic transmission, glutamatergic / PDZ domain binding / protein tetramerization / establishment of protein localization / postsynaptic density membrane / modulation of chemical synaptic transmission / cerebral cortex development / receptor internalization / Schaffer collateral - CA1 synapse / terminal bouton / synaptic vesicle / synaptic vesicle membrane / presynapse / signaling receptor activity / amyloid-beta binding / growth cone / presynaptic membrane / scaffold protein binding / perikaryon / chemical synaptic transmission / dendritic spine / postsynaptic membrane / neuron projection / postsynaptic density / axon / external side of plasma membrane / neuronal cell body / dendrite / synapse / protein kinase binding / protein-containing complex binding / glutamatergic synapse / cell surface / endoplasmic reticulum / protein-containing complex / identical protein binding / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
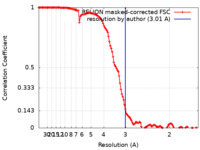
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.01 Å | |||||||||
 データ登録者 データ登録者 | Nakagawa T | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2024 ジャーナル: Nat Struct Mol Biol / 年: 2024タイトル: The open gate of the AMPA receptor forms a Ca binding site critical in regulating ion transport. 著者: Terunaga Nakagawa / Xin-Tong Wang / Federico J Miguez-Cabello / Derek Bowie /   要旨: Alpha-amino-3-hydroxyl-5-methyl-4-isoxazole-propionic acid receptors (AMPARs) are cation-selective ion channels that mediate most fast excitatory neurotransmission in the brain. Although their gating ...Alpha-amino-3-hydroxyl-5-methyl-4-isoxazole-propionic acid receptors (AMPARs) are cation-selective ion channels that mediate most fast excitatory neurotransmission in the brain. Although their gating mechanism has been studied extensively, understanding how cations traverse the pore has remained elusive. Here we investigated putative ion and water densities in the open pore of Ca-permeable AMPARs (rat GRIA2 flip-Q isoform) at 2.3-2.6 Å resolution. We show that the ion permeation pathway attains an extracellular Ca binding site (site-G) when the channel gate moves into the open configuration. Site-G is highly selective for Ca over Na, favoring the movement of Ca into the selectivity filter of the pore. Seizure-related N619K mutation, adjacent to site-G, promotes channel opening but attenuates Ca binding and thus diminishes Ca permeability. Our work identifies the importance of site-G, which coordinates with the Q/R site of the selectivity filter to ensure the preferential transport of Ca through the channel pore. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29384.map.gz emd_29384.map.gz | 166.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29384-v30.xml emd-29384-v30.xml emd-29384.xml emd-29384.xml | 19.5 KB 19.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29384_fsc.xml emd_29384_fsc.xml | 12.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29384.png emd_29384.png | 140.3 KB | ||
| マスクデータ |  emd_29384_msk_1.map emd_29384_msk_1.map | 178 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-29384.cif.gz emd-29384.cif.gz | 6.8 KB | ||
| その他 |  emd_29384_half_map_1.map.gz emd_29384_half_map_1.map.gz emd_29384_half_map_2.map.gz emd_29384_half_map_2.map.gz | 139.3 MB 139.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29384 http://ftp.pdbj.org/pub/emdb/structures/EMD-29384 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29384 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29384 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29384_validation.pdf.gz emd_29384_validation.pdf.gz | 1017.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29384_full_validation.pdf.gz emd_29384_full_validation.pdf.gz | 1017.1 KB | 表示 | |
| XML形式データ |  emd_29384_validation.xml.gz emd_29384_validation.xml.gz | 20 KB | 表示 | |
| CIF形式データ |  emd_29384_validation.cif.gz emd_29384_validation.cif.gz | 26.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29384 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29384 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29384 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29384 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8fqdMC  8fp4C  8fp9C  8fpcC  8fpgC  8fphC  8fpkC  8fplC  8fpsC  8fpvC  8fpyC  8fpzC  8fq1C  8fq2C  8fq3C  8fq5C  8fq6C  8fq8C  8fqaC  8fqbC  8fqeC  8fqfC  8fqgC  8fqhC  8fr0C C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29384.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29384.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | LBDconf1, Open-Ca10 | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.819 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_29384_msk_1.map emd_29384_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half1 map, Open-Ca10
| ファイル | emd_29384_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half1 map, Open-Ca10 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half2 map, Open-Ca10
| ファイル | emd_29384_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half2 map, Open-Ca10 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Homotetrameric assembly of GluA2 flip-Q isoform in complex with T...
| 全体 | 名称: Homotetrameric assembly of GluA2 flip-Q isoform in complex with TARP gamma2 (K52E, K53E). Dimer-of-dimers assembly. |
|---|---|
| 要素 |
|
-超分子 #1: Homotetrameric assembly of GluA2 flip-Q isoform in complex with T...
| 超分子 | 名称: Homotetrameric assembly of GluA2 flip-Q isoform in complex with TARP gamma2 (K52E, K53E). Dimer-of-dimers assembly. タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 500 KDa |
-分子 #1: Glutamate receptor 2
| 分子 | 名称: Glutamate receptor 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 98.854852 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MQKIMHISVL LSPVLWGLIF GVSSNSIQIG GLFPRGADQE YSAFRVGMVQ FSTSEFRLTP HIDNLEVANS FAVTNAFCSQ FSRGVYAIF GFYDKKSVNT ITSFCGTLHV SFITPSFPTD GTHPFVIQMR PDLKGALLSL IEYYQWDKFA YLYDSDRGLS T LQAVLDSA ...文字列: MQKIMHISVL LSPVLWGLIF GVSSNSIQIG GLFPRGADQE YSAFRVGMVQ FSTSEFRLTP HIDNLEVANS FAVTNAFCSQ FSRGVYAIF GFYDKKSVNT ITSFCGTLHV SFITPSFPTD GTHPFVIQMR PDLKGALLSL IEYYQWDKFA YLYDSDRGLS T LQAVLDSA AEKKWQVTAI NVGNINNDKK DETYRSLFQD LELKKERRVI LDCERDKVND IVDQVITIGK HVKGYHYIIA NL GFTDGDL LKIQFGGANV SGFQIVDYDD SLVSKFIERW STLEEKEYPG AHTATIKYTS ALTYDAVQVM TEAFRNLRKQ RIE ISRRGN AGDCLANPAV PWGQGVEIER ALKQVQVEGL SGNIKFDQNG KRINYTINIM ELKTNGPRKI GYWSEVDKMV VTLT ELPSG NDTSGLENKT VVVTTILESP YVMMKKNHEM LEGNERYEGY CVDLAAEIAK HCGFKYKLTI VGDGKYGARD ADTKI WNGM VGELVYGKAD IAIAPLTITL VREEVIDFSK PFMSLGISIM IKKPQKSKPG VFSFLDPLAY EIWMCIVFAY IGVSVV LFL VSRFSPYEWH TEEFEDGRET QSSESTNEFG IFNSLWFSLG AFMQQGCDIS PRSLSGRIVG GVWWFFTLII ISSYTAN LA AFLTVERMVS PIESAEDLSK QTEIAYGTLD SGSTKEFFRR SKIAVFDKMW TYMRSAEPSV FVRTTAEGVA RVRKSKGK Y AYLLESTMNE YIEQRKPCDT MKVGGNLDSK GYGIATPKGS SLGTPVNLAV LKLSEQGVLD KLKNKWWYDK GECGAKDSG SKEKTSALSL SNVAGVFYIL VGGLGLAMLV ALIEFCYKSR AEAKRMKVAK NPQNINPSSS QNSQNFATYK EGYNVYGIES VKI UniProtKB: Glutamate receptor 2 |
-分子 #2: GLUTAMIC ACID
| 分子 | 名称: GLUTAMIC ACID / タイプ: ligand / ID: 2 / コピー数: 4 / 式: GLU |
|---|---|
| 分子量 | 理論値: 147.129 Da |
| Chemical component information |  ChemComp-GLU: |
-分子 #3: CYCLOTHIAZIDE
| 分子 | 名称: CYCLOTHIAZIDE / タイプ: ligand / ID: 3 / コピー数: 4 / 式: CYZ |
|---|---|
| 分子量 | 理論値: 389.878 Da |
| Chemical component information |
-分子 #4: water
| 分子 | 名称: water / タイプ: ligand / ID: 4 / コピー数: 2 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 10 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
詳細: L-glutamic acid (100mM) and cyclothiazide (CTZ, 0.33mM) was added before freezing. The 1M L-glutamic acid stock solution is adjusted to pH 7.4 using NaOH | |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 28505 / 平均電子線量: 53.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー

































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)