+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-25680 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of dodecameric unphosphorylated Pediculus humanus (Ph) PINK1 D357A mutant | |||||||||
 マップデータ マップデータ | Dodecamer map (locally filtered) | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | PINK1 / Kinase / Transferase / Mitophagy / Parkinson's Disease / Ubiquitin / Phosphorylation / Phospho-ubiquitin | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報autophagy of mitochondrion / positive regulation of mitochondrial fission / regulation of apoptotic process / mitochondrial outer membrane / non-specific serine/threonine protein kinase / protein kinase activity / mitochondrial inner membrane / protein serine/threonine kinase activity / ATP binding / metal ion binding / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Pediculus humanus corporis (キモノジラミ) Pediculus humanus corporis (キモノジラミ) | |||||||||
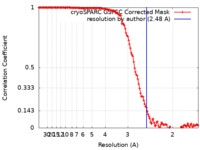
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.48 Å | |||||||||
 データ登録者 データ登録者 | Gan ZY / Leis A | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: Activation mechanism of PINK1. 著者: Zhong Yan Gan / Sylvie Callegari / Simon A Cobbold / Thomas R Cotton / Michael J Mlodzianoski / Alexander F Schubert / Niall D Geoghegan / Kelly L Rogers / Andrew Leis / Grant Dewson / Alisa ...著者: Zhong Yan Gan / Sylvie Callegari / Simon A Cobbold / Thomas R Cotton / Michael J Mlodzianoski / Alexander F Schubert / Niall D Geoghegan / Kelly L Rogers / Andrew Leis / Grant Dewson / Alisa Glukhova / David Komander /   要旨: Mutations in the protein kinase PINK1 lead to defects in mitophagy and cause autosomal recessive early onset Parkinson's disease. PINK1 has many unique features that enable it to phosphorylate ...Mutations in the protein kinase PINK1 lead to defects in mitophagy and cause autosomal recessive early onset Parkinson's disease. PINK1 has many unique features that enable it to phosphorylate ubiquitin and the ubiquitin-like domain of Parkin. Structural analysis of PINK1 from diverse insect species with and without ubiquitin provided snapshots of distinct structural states yet did not explain how PINK1 is activated. Here we elucidate the activation mechanism of PINK1 using crystallography and cryo-electron microscopy (cryo-EM). A crystal structure of unphosphorylated Pediculus humanus corporis (Ph; human body louse) PINK1 resolves an N-terminal helix, revealing the orientation of unphosphorylated yet active PINK1 on the mitochondria. We further provide a cryo-EM structure of a symmetric PhPINK1 dimer trapped during the process of trans-autophosphorylation, as well as a cryo-EM structure of phosphorylated PhPINK1 undergoing a conformational change to an active ubiquitin kinase state. Structures and phosphorylation studies further identify a role for regulatory PINK1 oxidation. Together, our research delineates the complete activation mechanism of PINK1, illuminates how PINK1 interacts with the mitochondrial outer membrane and reveals how PINK1 activity may be modulated by mitochondrial reactive oxygen species. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25680.map.gz emd_25680.map.gz | 11.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25680-v30.xml emd-25680-v30.xml emd-25680.xml emd-25680.xml | 19.7 KB 19.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_25680_fsc.xml emd_25680_fsc.xml | 14.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_25680.png emd_25680.png | 124.5 KB | ||
| マスクデータ |  emd_25680_msk_1.map emd_25680_msk_1.map | 209.3 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-25680.cif.gz emd-25680.cif.gz | 6.1 KB | ||
| その他 |  emd_25680_additional_1.map.gz emd_25680_additional_1.map.gz emd_25680_half_map_1.map.gz emd_25680_half_map_1.map.gz emd_25680_half_map_2.map.gz emd_25680_half_map_2.map.gz | 105.3 MB 193.9 MB 193.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25680 http://ftp.pdbj.org/pub/emdb/structures/EMD-25680 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25680 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25680 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_25680_validation.pdf.gz emd_25680_validation.pdf.gz | 995.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_25680_full_validation.pdf.gz emd_25680_full_validation.pdf.gz | 995.3 KB | 表示 | |
| XML形式データ |  emd_25680_validation.xml.gz emd_25680_validation.xml.gz | 21.5 KB | 表示 | |
| CIF形式データ |  emd_25680_validation.cif.gz emd_25680_validation.cif.gz | 27.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25680 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25680 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25680 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25680 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25680.map.gz / 形式: CCP4 / 大きさ: 209.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25680.map.gz / 形式: CCP4 / 大きさ: 209.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Dodecamer map (locally filtered) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.833 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_25680_msk_1.map emd_25680_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
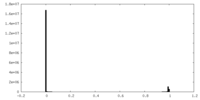
| 密度ヒストグラム |
-追加マップ: Dodecamer map (unsharpened)
| ファイル | emd_25680_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Dodecamer map (unsharpened) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
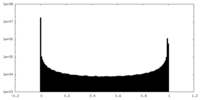
| 密度ヒストグラム |
-ハーフマップ: Dodecamer half map
| ファイル | emd_25680_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Dodecamer half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
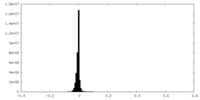
| 密度ヒストグラム |
-ハーフマップ: Dodecamer half map
| ファイル | emd_25680_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Dodecamer half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
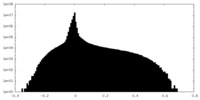
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Dodecameric unphosphorylated Pediculus humanus (Ph) PINK1 D357A mutant
| 全体 | 名称: Dodecameric unphosphorylated Pediculus humanus (Ph) PINK1 D357A mutant |
|---|---|
| 要素 |
|
-超分子 #1: Dodecameric unphosphorylated Pediculus humanus (Ph) PINK1 D357A mutant
| 超分子 | 名称: Dodecameric unphosphorylated Pediculus humanus (Ph) PINK1 D357A mutant タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Pediculus humanus corporis (キモノジラミ) Pediculus humanus corporis (キモノジラミ) |
| 分子量 | 理論値: 604 KDa |
-分子 #1: Serine/threonine-protein kinase PINK1, putative
| 分子 | 名称: Serine/threonine-protein kinase PINK1, putative / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO / EC番号: non-specific serine/threonine protein kinase |
|---|---|
| 由来(天然) | 生物種:  Pediculus humanus corporis (キモノジラミ) Pediculus humanus corporis (キモノジラミ) |
| 分子量 | 理論値: 52.929613 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GPSGLLTKDD ELEGICWEIR EAVSKGKWND SESENVEQLQ AANLDELDLG EPIAKGCNAV VYSAKLKNVQ SNKLAHQLAV KMMFNYDVE SNSTAILKAM YRETVPAMSY FFNQNLFNIE NISDFKIRLP PHPNIVRMYS VFADRIPDLQ CNKQLYPEAL P PRINPEGS ...文字列: GPSGLLTKDD ELEGICWEIR EAVSKGKWND SESENVEQLQ AANLDELDLG EPIAKGCNAV VYSAKLKNVQ SNKLAHQLAV KMMFNYDVE SNSTAILKAM YRETVPAMSY FFNQNLFNIE NISDFKIRLP PHPNIVRMYS VFADRIPDLQ CNKQLYPEAL P PRINPEGS GRNMSLFLVM KRYDCTLKEY LRDKTPNMRS SILLLSQLLE AVAHMNIHNI SHRDLKSDNI LVDLSEGDAY PT IVITAFG CCLCDKQNGL VIPYRSEDQD KGGNRALMAP EIANAKPGTF SWLNYKKSDL WAVGAIAYEI FNIDNPFYDK TMK LLSKSY KEEDLPELPD TIPFIIRNLV SNMLSRSTNK RLDCDVAATV AQLYLWAPSS WLKENYTLPN SNEIIQWLLC LSSK VLCER DITARNKTNT MSESVSKAQY KGRRSLPEYE LIASFLRRVR LHLVRKGLKW IQELHIYN UniProtKB: Serine/threonine-protein kinase Pink1, mitochondrial |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8.5 構成要素:
| ||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: OTHER / 前処理 - 気圧: 0.039 kPa | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 10 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 1.25 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm 最大 デフォーカス(公称値): 1.9000000000000001 µm 最小 デフォーカス(公称値): 0.4 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー



















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)