+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2230 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The architecture of human general transcription factor TFIID core complex | |||||||||
 マップデータ マップデータ | Cryo-EM structure of the recombinant human core-TFIID subcomplex | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | human TFIID / general transcription factor / transcription / multibac / recombinant protein | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報SAGA complex => GO:0000124 / SAGA complex => GO:0000124 / : / transcription cis-regulatory region binding => GO:0000976 / : / : / transcription factor TFTC complex / transcription factor TFIID complex / viral process / positive regulation of DNA-binding transcription factor activity ...SAGA complex => GO:0000124 / SAGA complex => GO:0000124 / : / transcription cis-regulatory region binding => GO:0000976 / : / : / transcription factor TFTC complex / transcription factor TFIID complex / viral process / positive regulation of DNA-binding transcription factor activity / transcription initiation at RNA polymerase II promoter / transcription elongation by RNA polymerase II / actin cytoskeleton / transcription coactivator activity / DNA-binding transcription factor activity / DNA binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 11.6 Å | |||||||||
 データ登録者 データ登録者 | Bieniossek C / Papai G / Schaffitzel C / Garzoni F / Chaillet M / Scheer E / Papadopoulos P / Tora L / Schultz P / Berger I | |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2013 ジャーナル: Nature / 年: 2013タイトル: The architecture of human general transcription factor TFIID core complex. 著者: Christoph Bieniossek / Gabor Papai / Christiane Schaffitzel / Frederic Garzoni / Maxime Chaillet / Elisabeth Scheer / Petros Papadopoulos / Laszlo Tora / Patrick Schultz / Imre Berger /  要旨: The initiation of gene transcription by RNA polymerase II is regulated by a plethora of proteins in human cells. The first general transcription factor to bind gene promoters is transcription factor ...The initiation of gene transcription by RNA polymerase II is regulated by a plethora of proteins in human cells. The first general transcription factor to bind gene promoters is transcription factor IID (TFIID). TFIID triggers pre-initiation complex formation, functions as a coactivator by interacting with transcriptional activators and reads epigenetic marks. TFIID is a megadalton-sized multiprotein complex composed of TATA-box-binding protein (TBP) and 13 TBP-associated factors (TAFs). Despite its crucial role, the detailed architecture and assembly mechanism of TFIID remain elusive. Histone fold domains are prevalent in TAFs, and histone-like tetramer and octamer structures have been proposed in TFIID. A functional core-TFIID subcomplex was revealed in Drosophila nuclei, consisting of a subset of TAFs (TAF4, TAF5, TAF6, TAF9 and TAF12). These core subunits are thought to be present in two copies in holo-TFIID, in contrast to TBP and other TAFs that are present in a single copy, conveying a transition from symmetry to asymmetry in the TFIID assembly pathway. Here we present the structure of human core-TFIID determined by cryo-electron microscopy at 11.6 Å resolution. Our structure reveals a two-fold symmetric, interlaced architecture, with pronounced protrusions, that accommodates all conserved structural features of the TAFs including the histone folds. We further demonstrate that binding of one TAF8-TAF10 complex breaks the original symmetry of core-TFIID. We propose that the resulting asymmetric structure serves as a functional scaffold to nucleate holo-TFIID assembly, by accreting one copy each of the remaining TAFs and TBP. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2230.map.gz emd_2230.map.gz | 290 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2230-v30.xml emd-2230-v30.xml emd-2230.xml emd-2230.xml | 22.6 KB 22.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  EMD-2230-core-TFIID-front.png EMD-2230-core-TFIID-front.png | 118 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2230 http://ftp.pdbj.org/pub/emdb/structures/EMD-2230 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2230 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2230 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_2230_validation.pdf.gz emd_2230_validation.pdf.gz | 193.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_2230_full_validation.pdf.gz emd_2230_full_validation.pdf.gz | 192.5 KB | 表示 | |
| XML形式データ |  emd_2230_validation.xml.gz emd_2230_validation.xml.gz | 5.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2230 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2230 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2230 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2230 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2230.map.gz / 形式: CCP4 / 大きさ: 8.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2230.map.gz / 形式: CCP4 / 大きさ: 8.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of the recombinant human core-TFIID subcomplex | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 3.048 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
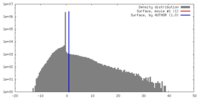
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Recombinant human core-TFIID complex containing TAF4, TAF5, TAF6,...
| 全体 | 名称: Recombinant human core-TFIID complex containing TAF4, TAF5, TAF6, TAF9 and TAF12. |
|---|---|
| 要素 |
|
-超分子 #1000: Recombinant human core-TFIID complex containing TAF4, TAF5, TAF6,...
| 超分子 | 名称: Recombinant human core-TFIID complex containing TAF4, TAF5, TAF6, TAF9 and TAF12. タイプ: sample / ID: 1000 / 詳細: The sample was fixed by GraFix. / 集合状態: Dimer / Number unique components: 5 |
|---|---|
| 分子量 | 理論値: 700 KDa |
-分子 #1: TATA box binding protein (TBP)-associated factor 5
| 分子 | 名称: TATA box binding protein (TBP)-associated factor 5 / タイプ: protein_or_peptide / ID: 1 / Name.synonym: TAF5 / コピー数: 2 / 集合状態: Dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus |
| 分子量 | 理論値: 100 KDa |
| 組換発現 | 生物種: Baculovirus EMBacY / 組換プラスミド: pTF |
| 配列 | GO: actin cytoskeleton, transcription factor TFIID complex, transcription factor TFTC complex, DNA-binding transcription factor activity, transcription cis-regulatory region binding => GO:0000976, GO: ...GO: actin cytoskeleton, transcription factor TFIID complex, transcription factor TFTC complex, DNA-binding transcription factor activity, transcription cis-regulatory region binding => GO:0000976, GO: 0016573, transcription elongation by RNA polymerase II, transcription initiation at RNA polymerase II promoter, viral process, GO: 0019048 InterPro: WD40 repeat, LIS1 homology motif, TFIID subunit TAF5, NTD2 domain, WD40/YVTN repeat-like-containing domain superfamily, INTERPRO: IPR017986, WD40 repeat, conserved site, G-protein beta WD-40 repeat |
-分子 #2: TATA box binding protein (TBP)-associated factor 6
| 分子 | 名称: TATA box binding protein (TBP)-associated factor 6 / タイプ: protein_or_peptide / ID: 2 / Name.synonym: TAF6 / コピー数: 2 / 集合状態: Dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus |
| 分子量 | 理論値: 70 KDa |
| 組換発現 | 生物種: Baculovirus EMBacY / 組換プラスミド: pTF |
| 配列 | GO: actin cytoskeleton, transcription factor TFIID complex, transcription factor TFTC complex, DNA-binding transcription factor activity, transcription cis-regulatory region binding => GO:0000976, GO: ...GO: actin cytoskeleton, transcription factor TFIID complex, transcription factor TFTC complex, DNA-binding transcription factor activity, transcription cis-regulatory region binding => GO:0000976, GO: 0016573, transcription elongation by RNA polymerase II, transcription initiation at RNA polymerase II promoter, viral process, GO: 0019048 InterPro: TATA box binding protein associated factor (TAF), histone-like fold domain, Histone-fold, TAF6, C-terminal HEAT repeat domain |
-分子 #3: TATA box binding protein (TBP)-associated factor 9
| 分子 | 名称: TATA box binding protein (TBP)-associated factor 9 / タイプ: protein_or_peptide / ID: 3 / Name.synonym: TAF9 / コピー数: 2 / 集合状態: Dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus |
| 分子量 | 理論値: 32 KDa |
| 組換発現 | 生物種: Baculovirus EMBacY / 組換プラスミド: pTF |
| 配列 | GO: actin cytoskeleton, transcription factor TFIID complex, transcription factor TFTC complex, DNA-binding transcription factor activity, transcription cis-regulatory region binding => GO:0000976, GO: ...GO: actin cytoskeleton, transcription factor TFIID complex, transcription factor TFTC complex, DNA-binding transcription factor activity, transcription cis-regulatory region binding => GO:0000976, GO: 0016573, transcription elongation by RNA polymerase II, transcription initiation at RNA polymerase II promoter, viral process, GO: 0019048 InterPro: Transcription initiation factor TAFII31, Histone-fold |
-分子 #4: TATA box binding protein (TBP)-associated factor 4
| 分子 | 名称: TATA box binding protein (TBP)-associated factor 4 / タイプ: protein_or_peptide / ID: 4 / Name.synonym: TAF4 / コピー数: 2 / 集合状態: Dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus |
| 分子量 | 理論値: 135 KDa |
| 組換発現 | 生物種: Baculovirus EMBacY / 組換プラスミド: pTF |
| 配列 | GO: actin cytoskeleton, transcription factor TFIID complex, transcription factor TFTC complex, DNA-binding transcription factor activity, transcription cis-regulatory region binding => GO:0000976, GO: ...GO: actin cytoskeleton, transcription factor TFIID complex, transcription factor TFTC complex, DNA-binding transcription factor activity, transcription cis-regulatory region binding => GO:0000976, GO: 0016573, transcription elongation by RNA polymerase II, transcription initiation at RNA polymerase II promoter, viral process, GO: 0019048 InterPro: TAFH/NHR1, Transcription initiation factor TFIID component TAF4, C-terminal, Histone-fold |
-分子 #5: TATA box binding protein (TBP)-associated factor 12
| 分子 | 名称: TATA box binding protein (TBP)-associated factor 12 / タイプ: protein_or_peptide / ID: 5 / Name.synonym: TAF12 / コピー数: 2 / 集合状態: Dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus Homo sapiens (ヒト) / 別称: Human / 細胞中の位置: Nucleus |
| 分子量 | 理論値: 15 KDa |
| 組換発現 | 生物種: Baculovirus EMBacY / 組換プラスミド: pTF |
| 配列 | GO: SAGA complex => GO:0000124, SAGA complex => GO:0000124, transcription factor TFIID complex, transcription factor TFTC complex, DNA binding, transcription coactivator activity, GO: 0043966, ...GO: SAGA complex => GO:0000124, SAGA complex => GO:0000124, transcription factor TFIID complex, transcription factor TFTC complex, DNA binding, transcription coactivator activity, GO: 0043966, positive regulation of DNA-binding transcription factor activity, transcription elongation by RNA polymerase II, transcription initiation at RNA polymerase II promoter, viral process InterPro: Histone-fold, Transcription initiation factor TFIID subunit 12 domain |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 8 / 詳細: 50mM HEPES pH 8.0, 150mM KCl |
| グリッド | 詳細: Quantifoil 300 mesh Cu/Rh holey carbon grid R2/2 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / 装置: FEI VITROBOT MARK IV / 手法: 4s, blot force 5 |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI 20 |
|---|---|
| 日付 | 2011年5月7日 |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: OTHER / デジタル化 - サンプリング間隔: 15.24 µm / 実像数: 23 / 平均電子線量: 16 e/Å2 / ビット/ピクセル: 16 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 50012 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 3.749 µm / 最小 デフォーカス(公称値): 1.851 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダーモデル: GATAN LIQUID NITROGEN |
- 画像解析
画像解析
| 詳細 | Picking was done with e2boxer from EMAN2, first alignment cycles were done in Imagic and refinement in Spider. |
|---|---|
| CTF補正 | 詳細: Each particle |
| 最終 再構成 | 想定した対称性 - 点群: C2 (2回回転対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 11.6 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: Imagic, Spider / 使用した粒子像数: 12566 |
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - #0 - Chain ID: A / Chain - #1 - Chain ID: B |
|---|---|
| ソフトウェア | 名称: Chimera, Situs |
| 詳細 | Protocol: Rigid body |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
-原子モデル構築 2
| 初期モデル | PDB ID: Chain - #0 - Chain ID: A / Chain - #1 - Chain ID: B |
|---|---|
| ソフトウェア | 名称: Chimera, Situs |
| 詳細 | Protocol: Rigid body |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
-原子モデル構築 3
| 初期モデル | PDB ID: Chain - Chain ID: D |
|---|---|
| ソフトウェア | 名称: Chimera, Situs |
| 詳細 | Protocol: Rigid body |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
-原子モデル構築 4
| 初期モデル | PDB ID: Chain - Chain ID: A |
|---|---|
| ソフトウェア | 名称: Chimera, Situs |
| 詳細 | Protocol: Rigid body |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
-原子モデル構築 5
| 初期モデル | PDB ID: Chain - Chain ID: A |
|---|---|
| ソフトウェア | 名称: Chimera, Situs |
| 詳細 | Protocol: Rigid body |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
-原子モデル構築 6
| 初期モデル | PDB ID: Chain - Chain ID: A |
|---|---|
| ソフトウェア | 名称: Chimera, Situs |
| 詳細 | Protocol: Rigid body |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)