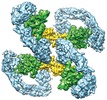
登録情報 データベース : EMDB / ID : EMD-20578タイトル Cryo-EM structure of RET/GFRa2/NRTN extracellular complex in the tetrameric form Cryo-EM structure of RET/GFRa2/NRTN extracellular complex in the tetrameric form. 複合体 : RET, GFRAL and GDF15 extracellular complexタンパク質・ペプチド : Neurturinタンパク質・ペプチド : GDNF family receptor alpha-2タンパク質・ペプチド : Proto-oncogene tyrosine-protein kinase receptor Retリガンド : CALCIUM IONリガンド : 2-acetamido-2-deoxy-beta-D-glucopyranose機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 4.3 Å Li J / Shang GJ / Chen YJ / Brautigam CA / Liou J / Zhang XW / Bai XC ジャーナル : Elife / 年 : 2019タイトル : Cryo-EM analyses reveal the common mechanism and diversification in the activation of RET by different ligands.著者 : Jie Li / Guijun Shang / Yu-Ju Chen / Chad A Brautigam / Jen Liou / Xuewu Zhang / Xiao-Chen Bai / 要旨 : RET is a receptor tyrosine kinase (RTK) that plays essential roles in development and has been implicated in several human diseases. Different from most of RTKs, RET requires not only its cognate ... RET is a receptor tyrosine kinase (RTK) that plays essential roles in development and has been implicated in several human diseases. Different from most of RTKs, RET requires not only its cognate ligands but also co-receptors for activation, the mechanisms of which remain unclear due to lack of high-resolution structures of the ligand/co-receptor/receptor complexes. Here, we report cryo-EM structures of the extracellular region ternary complexes of GDF15/GFRAL/RET, GDNF/GFRα1/RET, NRTN/GFRα2/RET and ARTN/GFRα3/RET. These structures reveal that all the four ligand/co-receptor pairs, while using different atomic interactions, induce a specific dimerization mode of RET that is poised to bring the two kinase domains into close proximity for cross-phosphorylation. The NRTN/GFRα2/RET dimeric complex further pack into a tetrameric assembly, which is shown by our cell-based assays to regulate the endocytosis of RET. Our analyses therefore reveal both the common mechanism and diversification in the activation of RET by different ligands. 履歴 登録 2019年8月8日 - ヘッダ(付随情報) 公開 2019年10月2日 - マップ公開 2019年10月2日 - 更新 2020年7月29日 - 現状 2020年7月29日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: Elife / 年: 2019
ジャーナル: Elife / 年: 2019
 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_20578.map.gz
emd_20578.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-20578-v30.xml
emd-20578-v30.xml emd-20578.xml
emd-20578.xml EMDBヘッダ
EMDBヘッダ emd_20578.png
emd_20578.png http://ftp.pdbj.org/pub/emdb/structures/EMD-20578
http://ftp.pdbj.org/pub/emdb/structures/EMD-20578 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20578
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20578 emd_20578_validation.pdf.gz
emd_20578_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_20578_full_validation.pdf.gz
emd_20578_full_validation.pdf.gz emd_20578_validation.xml.gz
emd_20578_validation.xml.gz emd_20578_validation.cif.gz
emd_20578_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20578
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20578 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20578
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20578 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_20578.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_20578.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析
 ムービー
ムービー コントローラー
コントローラー