+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure for mouse leptin in complex with the mouse LEP-R ectodomain (1:2 mLEP:mLEPR model) | |||||||||
 マップデータ マップデータ | Sharpened cryo-EM map following non-uniform refinement | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | leptin / LEP-R / obesity / metabolism / energy balance / CYTOKINE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Synthesis, secretion, and deacylation of Ghrelin / regulation of lipoprotein lipid oxidation / cellular response to L-ascorbic acid / positive regulation of fat cell apoptotic process / negative regulation of glutamine transport / leptin receptor activity / regulation of transport / negative regulation of appetite by leptin-mediated signaling pathway / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / negative regulation of glucagon secretion ...Synthesis, secretion, and deacylation of Ghrelin / regulation of lipoprotein lipid oxidation / cellular response to L-ascorbic acid / positive regulation of fat cell apoptotic process / negative regulation of glutamine transport / leptin receptor activity / regulation of transport / negative regulation of appetite by leptin-mediated signaling pathway / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / negative regulation of glucagon secretion / regulation of endothelial cell proliferation / regulation of natural killer cell mediated cytotoxicity / regulation of natural killer cell proliferation / leptin receptor binding / regulation of bone remodeling / positive regulation of luteinizing hormone secretion / bone growth / regulation of natural killer cell activation / glycerol biosynthetic process / regulation of steroid biosynthetic process / elastin metabolic process / leptin-mediated signaling pathway / positive regulation of follicle-stimulating hormone secretion / positive regulation of monoatomic ion transport / regulation of intestinal cholesterol absorption / positive regulation of hepatic stellate cell activation / regulation of feeding behavior / regulation of brown fat cell differentiation / positive regulation of peroxisome proliferator activated receptor signaling pathway / regulation of nitric-oxide synthase activity / adult feeding behavior / activation of protein kinase C activity / bone mineralization involved in bone maturation / regulation of lipid biosynthetic process / sexual reproduction / response to leptin / negative regulation of cartilage development / ovulation from ovarian follicle / negative regulation of D-glucose import / negative regulation of appetite / positive regulation of developmental growth / leukocyte tethering or rolling / energy reserve metabolic process / bile acid metabolic process / cellular response to leptin stimulus / prostaglandin secretion / cardiac muscle hypertrophy / regulation of protein localization to nucleus / hormone metabolic process / positive regulation of p38MAPK cascade / cell surface receptor signaling pathway via STAT / regulation of fat cell differentiation / intestinal absorption / insulin secretion / eating behavior / aorta development / regulation of metabolic process / negative regulation of vasoconstriction / regulation of gluconeogenesis / response to vitamin E / glycogen metabolic process / peptide hormone receptor binding / fatty acid beta-oxidation / regulation of cytokine production involved in inflammatory response / central nervous system neuron development / response to dietary excess / energy homeostasis / peptide hormone binding / negative regulation of lipid storage / T cell differentiation / positive regulation of TOR signaling / cell surface receptor signaling pathway via JAK-STAT / regulation of angiogenesis / positive regulation of insulin receptor signaling pathway / negative regulation of gluconeogenesis / adipose tissue development / phagocytosis / glial cell proliferation / cholesterol metabolic process / cellular response to retinoic acid / positive regulation of T cell proliferation / positive regulation of interleukin-12 production / regulation of insulin secretion / negative regulation of autophagy / placenta development / response to activity / gluconeogenesis / determination of adult lifespan / positive regulation of interleukin-8 production / positive regulation of receptor signaling pathway via JAK-STAT / female pregnancy / response to insulin / circadian rhythm / hormone activity / lipid metabolic process / regulation of blood pressure / positive regulation of interleukin-6 production / positive regulation of protein import into nucleus / cellular response to insulin stimulus / glucose metabolic process 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
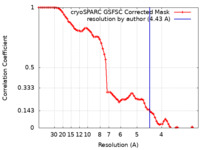
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.43 Å | |||||||||
 データ登録者 データ登録者 | Verstraete K / Savvides SN / Verschueren KG / Tsirigotaki A | |||||||||
| 資金援助 |  ベルギー, 1件 ベルギー, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Mechanism of receptor assembly via the pleiotropic adipokine Leptin. 著者: Alexandra Tsirigotaki / Ann Dansercoer / Koen H G Verschueren / Iva Marković / Christoph Pollmann / Maximillian Hafer / Jan Felix / Catherine Birck / Wouter Van Putte / Dominiek Catteeuw / ...著者: Alexandra Tsirigotaki / Ann Dansercoer / Koen H G Verschueren / Iva Marković / Christoph Pollmann / Maximillian Hafer / Jan Felix / Catherine Birck / Wouter Van Putte / Dominiek Catteeuw / Jan Tavernier / J Fernando Bazan / Jacob Piehler / Savvas N Savvides / Kenneth Verstraete /     要旨: The adipokine Leptin activates its receptor LEP-R in the hypothalamus to regulate body weight and exerts additional pleiotropic functions in immunity, fertility and cancer. However, the structure and ...The adipokine Leptin activates its receptor LEP-R in the hypothalamus to regulate body weight and exerts additional pleiotropic functions in immunity, fertility and cancer. However, the structure and mechanism of Leptin-mediated LEP-R assemblies has remained unclear. Intriguingly, the signaling-competent isoform of LEP-R is only lowly abundant amid several inactive short LEP-R isoforms contributing to a mechanistic conundrum. Here we show by X-ray crystallography and cryo-EM that, in contrast to long-standing paradigms, Leptin induces type I cytokine receptor assemblies featuring 3:3 stoichiometry and demonstrate such Leptin-induced trimerization of LEP-R on living cells via single-molecule microscopy. In mediating these assemblies, Leptin undergoes drastic restructuring that activates its site III for binding to the Ig domain of an adjacent LEP-R. These interactions are abolished by mutations linked to obesity. Collectively, our study provides the structural and mechanistic framework for how evolutionarily conserved Leptin:LEP-R assemblies with 3:3 stoichiometry can engage distinct LEP-R isoforms to achieve signaling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15677.map.gz emd_15677.map.gz | 38.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15677-v30.xml emd-15677-v30.xml emd-15677.xml emd-15677.xml | 24.1 KB 24.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15677_fsc.xml emd_15677_fsc.xml | 7.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15677.png emd_15677.png | 101.8 KB | ||
| マスクデータ |  emd_15677_msk_1.map emd_15677_msk_1.map | 40.6 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-15677.cif.gz emd-15677.cif.gz | 7.5 KB | ||
| その他 |  emd_15677_additional_1.map.gz emd_15677_additional_1.map.gz emd_15677_half_map_1.map.gz emd_15677_half_map_1.map.gz emd_15677_half_map_2.map.gz emd_15677_half_map_2.map.gz | 20.4 MB 37.7 MB 37.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15677 http://ftp.pdbj.org/pub/emdb/structures/EMD-15677 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15677 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15677 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15677_validation.pdf.gz emd_15677_validation.pdf.gz | 812.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15677_full_validation.pdf.gz emd_15677_full_validation.pdf.gz | 812 KB | 表示 | |
| XML形式データ |  emd_15677_validation.xml.gz emd_15677_validation.xml.gz | 14.6 KB | 表示 | |
| CIF形式データ |  emd_15677_validation.cif.gz emd_15677_validation.cif.gz | 18.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15677 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15677 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15677 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15677 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8avbMC  7z3pC  7z3qC  7z3rC  8av2C  8avcC  8avdC  8aveC  8avfC  8avoC  8b7qC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15677.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15677.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened cryo-EM map following non-uniform refinement | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.51 Å | ||||||||||||||||||||||||||||||||||||
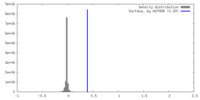
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_15677_msk_1.map emd_15677_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
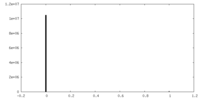
| 密度ヒストグラム |
-追加マップ: Non-sharpened cryo-EM map following non-uniform refinement
| ファイル | emd_15677_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Non-sharpened cryo-EM map following non-uniform refinement | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
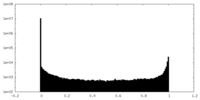
| 密度ヒストグラム |
-ハーフマップ: Half map A
| ファイル | emd_15677_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
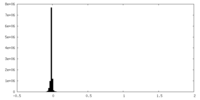
| 密度ヒストグラム |
-ハーフマップ: Half map B
| ファイル | emd_15677_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex between mouse leptin and the mouse LEP-R ectodomain.
| 全体 | 名称: Complex between mouse leptin and the mouse LEP-R ectodomain. |
|---|---|
| 要素 |
|
-超分子 #1: Complex between mouse leptin and the mouse LEP-R ectodomain.
| 超分子 | 名称: Complex between mouse leptin and the mouse LEP-R ectodomain. タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: The mouse leptin:LEP-R complex was isolated from the excess of mouse leptin via size-exclusion chromatography. The elution peak corresponding to the leptin:LEP-R was concentrated to 5 mg/mL, ...詳細: The mouse leptin:LEP-R complex was isolated from the excess of mouse leptin via size-exclusion chromatography. The elution peak corresponding to the leptin:LEP-R was concentrated to 5 mg/mL, aliquoted and flash frozen into liquid nitrogen. Just before plunge freezing the sample was diluted to 0.2 mg/mL. |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 230 KDa |
-分子 #1: Leptin
| 分子 | 名称: Leptin / タイプ: protein_or_peptide / ID: 1 詳細: Mouse leptin was expressed with an N-terminal His-tag. Before complex formation with the mouse LEP-R ecotodomain, the His-tag was removed with TEV protease コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 16.434676 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GGSTGGVPIQ KVQDDTKTLI KTIVTRINDI SHTQSVSAKQ RVTGLDFIPG LHPILSLSKM DQTLAVYQQV LTSLPSQNVL QIANDLENL RDLLHLLAFS KSCSLPQTSG LQKPESLDGV LEASLYSTEV VALSRLQGSL QDILQQLDVS PEC UniProtKB: Leptin |
-分子 #2: Leptin receptor
| 分子 | 名称: Leptin receptor / タイプ: protein_or_peptide / ID: 2 詳細: The N-terminally His-tagged LEP-R ecotomain was secreted from HEK293 FreeStyle cells. The N-terminal His-tag was not removed before complex formation with refolded mouse leptin. コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 94.081344 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: AHHHHHHPGG PGSDELDLNL AYPISPWKFK LFCGPPNTTD DSFLSPAGAP NNASALKGAS EAIVEAKFNS SGIYVPELSK TVFHCCFGN EQGQNCSALT DNTEGKTLAS VVKASVFRQL GVNWDIECWM KGDLTLFICH MEPLPKNPFK NYDSKVHLLY D LPEVIDDS ...文字列: AHHHHHHPGG PGSDELDLNL AYPISPWKFK LFCGPPNTTD DSFLSPAGAP NNASALKGAS EAIVEAKFNS SGIYVPELSK TVFHCCFGN EQGQNCSALT DNTEGKTLAS VVKASVFRQL GVNWDIECWM KGDLTLFICH MEPLPKNPFK NYDSKVHLLY D LPEVIDDS PLPPLKDSFQ TVQCNCSLRG CECHVPVPRA KLNYALLMYL EITSAGVSFQ SPLMSLQPML VVKPDPPLGL HM EVTDDGN LKISWDSQTM APFPLQYQVK YLENSTIVRE AAEIVSATSL LVDSVLPGSS YEVQVRSKRL DGSGVWSDWS SPQ VFTTQD VVYFPPKILT SVGSNASFHC IYKNENQIIS SKQIVWWRNL AEKIPEIQYS IVSDRVSKVT FSNLKATRPR GKFT YDAVY CCNEQACHHR YAELYVIDVN INISCETDGY LTKMTCRWSP STIQSLVGST VQLRYHRRSL YCPDSPSIHP TSEPK NCVL QRDGFYECVF QPIFLLSGYT MWIRINHSLG SLDSPPTCVL PDSVVKPLPP SNVKAEITVN TGLLKVSWEK PVFPEN NLQ FQIRYGLSGK EIQWKTHEVF DAKSKSASLL VSDLCAVYVV QVRCRRLDGL GYWSNWSSPA YTLVMDVKVP MRGPEFW RK MDGDVTKKER NVTLLWKPLT KNDSLCSVRR YVVKHRTAHN GTWSEDVGNR TNLTFLWTEP AHTVTVLAVN SLGASLVN F NLTFSWPMSK VSAVESLSAY PLSSSCVILS WTLSPDDYSL LYLVIEWKIL NEDDGMKWLR IPSNVKKFYI HDNFIPIEK YQFSLYPVFM EGVGKPKIIN GFTKDAIDKQ QNDAG UniProtKB: Leptin receptor |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
詳細: 20 mM Hepes, 150 mM NaCl, pH 7.4 | |||||||||
| グリッド | モデル: Quantifoil R0.6/1 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GRAPHENE / 支持フィルム - トポロジー: CONTINUOUS / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 1 sec. / 前処理 - 雰囲気: AIR | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK IV | |||||||||
| 詳細 | The mouse leptin:LEP-R complex was isolated from the excess of mouse leptin via size-exclusion chromatography. The elution peak corresponding to the leptin:LEP-R was concentrated to 5 mg/mL, aliquoted and flash frozen into liquid nitrogen. Just before plunge freezing the sample was diluted to 0.2 mg/mL. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL CRYO ARM 300 |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 7100 / 平均電子線量: 62.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: OTHER / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.8 µm |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 詳細 | An atomic model for a 1:2 mLeptin:LEP-RIgCRH2FnIII complex was created based on the AlphaFold prediction for mLEP-RECD and the determined mLeptin:mLEP-RIgCRH2 and mLEP-RFnIII module crystal structures and fitted in the cryo-EM map via Chimera followed by real space refinement in Phenix using rigid body refinement and coordinate refinement with reference restraints to the starting model and hydrogen-bonding restraints across the site II and site III mLeptin:mLEP-R interface regions. |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
| 得られたモデル |  PDB-8avb: |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)