+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | PAPP-A dimer in complex with its inhibitor STC2 (CASP target) | |||||||||
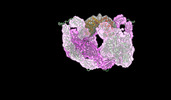
 マップデータ マップデータ | Composit map of PAPP-A dimer in complex with its endogenous inhibitor STC2 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Metzincin metalloprotease Inhibitor complex / HYDROLASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of hormone biosynthetic process / pappalysin-1 / regulation of store-operated calcium entry / response to vitamin D / negative regulation of multicellular organism growth / decidualization / endoplasmic reticulum unfolded protein response / embryo implantation / Post-translational protein phosphorylation / female pregnancy ...regulation of hormone biosynthetic process / pappalysin-1 / regulation of store-operated calcium entry / response to vitamin D / negative regulation of multicellular organism growth / decidualization / endoplasmic reticulum unfolded protein response / embryo implantation / Post-translational protein phosphorylation / female pregnancy / response to peptide hormone / hormone activity / metalloendopeptidase activity / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / intracellular calcium ion homeostasis / metallopeptidase activity / response to oxidative stress / cellular response to hypoxia / cell surface receptor signaling pathway / endoplasmic reticulum lumen / negative regulation of gene expression / heme binding / perinuclear region of cytoplasm / enzyme binding / endoplasmic reticulum / Golgi apparatus / protein homodimerization activity / proteolysis / extracellular space / extracellular region / zinc ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.02 Å | |||||||||
 データ登録者 データ登録者 | Kobbero SD / Gajhede M / Mirza OA / Boesen T / Oxvig C | |||||||||
| 資金援助 |  デンマーク, 1件 デンマーク, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structure of the proteolytic enzyme PAPP-A with the endogenous inhibitor stanniocalcin-2 reveals its inhibitory mechanism. 著者: Sara Dam Kobberø / Michael Gajhede / Osman Asghar Mirza / Søren Kløverpris / Troels Rønn Kjær / Jakob Hauge Mikkelsen / Thomas Boesen / Claus Oxvig /  要旨: The metzincin metalloproteinase PAPP-A plays a key role in the regulation of insulin-like growth factor (IGF) signaling by specific cleavage of inhibitory IGF binding proteins (IGFBPs). Using single- ...The metzincin metalloproteinase PAPP-A plays a key role in the regulation of insulin-like growth factor (IGF) signaling by specific cleavage of inhibitory IGF binding proteins (IGFBPs). Using single-particle cryo-electron microscopy (cryo-EM), we here report the structure of PAPP-A in complex with its endogenous inhibitor, stanniocalcin-2 (STC2), neither of which have been reported before. The highest resolution (3.1 Å) was obtained for the STC2 subunit and the N-terminal approximately 1000 residues of the PAPP-A subunit. The 500 kDa 2:2 PAPP-A·STC2 complex is a flexible multidomain ensemble with numerous interdomain contacts. In particular, a specific disulfide bond between the subunits of STC2 and PAPP-A prevents dissociation, and interactions between STC2 and a module located in the very C-terminal end of the PAPP-A subunit prevent binding of its main substrate, IGFBP-4. While devoid of activity towards IGFBP-4, the active site cleft of the catalytic domain is accessible in the inhibited PAPP-A·STC2 complex, as shown by its ability to hydrolyze a synthetic peptide derived from IGFBP-4. Relevant to multiple human pathologies, this unusual mechanism of proteolytic inhibition may support the development of specific pharmaceutical agents, by which IGF signaling can be indirectly modulated. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15221.map.gz emd_15221.map.gz | 55.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15221-v30.xml emd-15221-v30.xml emd-15221.xml emd-15221.xml | 25.9 KB 25.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_15221.png emd_15221.png | 48.4 KB | ||
| Filedesc metadata |  emd-15221.cif.gz emd-15221.cif.gz | 7.4 KB | ||
| その他 |  emd_15221_additional_1.map.gz emd_15221_additional_1.map.gz emd_15221_additional_2.map.gz emd_15221_additional_2.map.gz emd_15221_additional_3.map.gz emd_15221_additional_3.map.gz | 59.4 MB 59.3 MB 38.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15221 http://ftp.pdbj.org/pub/emdb/structures/EMD-15221 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15221 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15221 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15221_validation.pdf.gz emd_15221_validation.pdf.gz | 483.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15221_full_validation.pdf.gz emd_15221_full_validation.pdf.gz | 483.1 KB | 表示 | |
| XML形式データ |  emd_15221_validation.xml.gz emd_15221_validation.xml.gz | 6.5 KB | 表示 | |
| CIF形式データ |  emd_15221_validation.cif.gz emd_15221_validation.cif.gz | 7.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15221 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15221 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15221 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15221 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15221.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15221.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Composit map of PAPP-A dimer in complex with its endogenous inhibitor STC2 | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.18594 Å | ||||||||||||||||||||||||||||||||||||
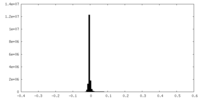
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Submap of composite map EMDB ID: EMD-15217
| ファイル | emd_15221_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
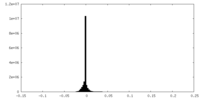
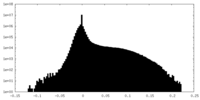
| 注釈 | Submap of composite map EMDB ID: EMD-15217 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
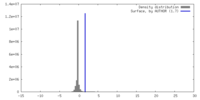
| 密度ヒストグラム |
-追加マップ: Submap of composite map EMDB ID: EMD-15219
| ファイル | emd_15221_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
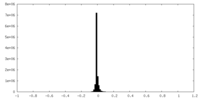
| 注釈 | Submap of composite map EMDB ID: EMD-15219 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
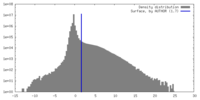
| 密度ヒストグラム |
-追加マップ: Submap of composite map EMDB ID: EMD-15220
| ファイル | emd_15221_additional_3.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
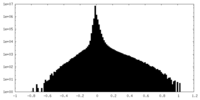
| 注釈 | Submap of composite map EMDB ID: EMD-15220 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
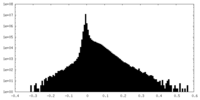
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : PAPP-A dimer in complex with its endogenous inhibitor STC2 dimer
| 全体 | 名称: PAPP-A dimer in complex with its endogenous inhibitor STC2 dimer |
|---|---|
| 要素 |
|
-超分子 #1: PAPP-A dimer in complex with its endogenous inhibitor STC2 dimer
| 超分子 | 名称: PAPP-A dimer in complex with its endogenous inhibitor STC2 dimer タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 詳細: Inhibited proteolytic complex generated by harvest of serum media, purifying on a nickel column followed by negative affinity purification and size-exclusion chromatography. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular |
| 分子量 | 理論値: 100 KDa |
-超分子 #2: Pregnancy-associated plasma protein A
| 超分子 | 名称: Pregnancy-associated plasma protein A / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #2 / 詳細: Homodimer |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular |
-超分子 #3: Stanniocalcin-2
| 超分子 | 名称: Stanniocalcin-2 / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #1 / 詳細: Homodimer |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular |
-分子 #1: Stanniocalcin-2
| 分子 | 名称: Stanniocalcin-2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 細胞: extracellular Homo sapiens (ヒト) / 細胞: extracellular |
| 分子量 | 理論値: 18.922953 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: RLSLQNTAEI QHCLVNAGDV GCGVFECFEN NSCEIRGLHG ICMTFLHNAG KFDAQGKSFI KDALKCKAHA LRHRFGCISR KCPAIREMV SQLQRECYLK HDLCAAAQEN TRVIVEMIHF KDLLLHEPYV DLVNLLLTCG EEVKEAITHS VQVQCEQNWG S LCSILSFC UniProtKB: Stanniocalcin-2 |
-分子 #2: Pappalysin-1
| 分子 | 名称: Pappalysin-1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO / EC番号: pappalysin-1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 器官: Ubiquitous / 細胞: Extracellular Homo sapiens (ヒト) / 器官: Ubiquitous / 細胞: Extracellular |
| 分子量 | 理論値: 171.143047 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: EARGATEEPS PPSRALYFSG RGEQLRLRAD LELPRDAFTL QVWLRAEGGQ RSPAVITGLY DKCSYISRDR GWVVGIHTIS DQDNKDPRY FFSLKTDRAR QVTTINAHRS YLPGQWVYLA ATYDGQFMKL YVNGAQVATS GEQVGGIFSP LTQKCKVLML G GSALNHNY ...文字列: EARGATEEPS PPSRALYFSG RGEQLRLRAD LELPRDAFTL QVWLRAEGGQ RSPAVITGLY DKCSYISRDR GWVVGIHTIS DQDNKDPRY FFSLKTDRAR QVTTINAHRS YLPGQWVYLA ATYDGQFMKL YVNGAQVATS GEQVGGIFSP LTQKCKVLML G GSALNHNY RGYIEHFSLW KVARTQREIL SDMETHGAHT ALPQLLLQEN WDNVKHAWSP MKDGSSPKVE FSNAHGFLLD TS LEPPLCG QTLCDNTEVI ASYNQLSSFR QPKVVRYRVV NLYEDDHKNP TVTREQVDFQ HHQLAEAFKQ YNISWELDVL EVS NSSLRR RLILANCDIS KIGDENCDPE CNHTLTGHDG GDCRHLRHPA FVKKQHNGVC DMDCNYERFN FDGGECCDPE ITNV TQTCF DPDSPHRAYL DVNELKNILK LDGSTHLNIF FAKSSEEELA GVATWPWDKE ALMHLGGIVL NPSFYGMPGH THTMI HQIG HSLGLYHVFR GISEIQSCSD PCMETEPSFE TGDLCNDTNP APKHKSCGDP GPGNDTCGFH SFFNTPYNNF MSYADD DCT DSFTPNQVAR MHCYLDLVYQ GWQPSRKPAP VALAPQVLGH TTDSVTLEWF PPIDGHFFER ELGSACHLCL EGRILVQ YA SNASSPMPCS PSGHWSPREA EGHPDVEQPC KSSVRTWSPN SAVNPHTVPP ACPEPQGCYL ELEFLYPLVP ESLTIWVT F VSTDWDSSGA VNDIKLLAVS GKNISLGPQN VFCDVPLTIR LWDVGEEVYG IQIYTLDEHL EIDAAMLTST ADTPLCLQC KPLKYKVVRD PPLQMDVASI LHLNRKFVDM DLNLGSVYQY WVITISGTEE SEPSPAVTYI HGSGYCGDGI IQKDQGEQCD DMNKINGDG CSLFCRQEVS FNCIDEPSRC YFHDGDGVCE EFEQKTSIKD CGVYTPQGFL DQWASNASVS HQDQQCPGWV I IGQPAASQ VCRTKVIDLS EGISQHAWYP CTISYPYSQL AQTTFWLRAY FSQPMVAAAV IVHLVTDGTY YGDQKQETIS VQ LLDTKDQ SHDLGLHVLS CRNNPLIIPV VHDLSQPFYH SQAVRVSFSS PLVAISGVAL RSFDNFDPVT LSSCQRGETY SPA EQSCVH FACEKTDCPE LAVENASLNC SSSDRYHGAQ CTVSCRTGYV LQIRRDDELI KSQTGPSVTV TCTEGKWNKQ VACE PVDCS IPDHHQVYAA SFSCPEGTTF GSQCSFQCRH PAQLKGNNSL LTCMEDGLWS FPEALCELMC LAPPPVPNAD LQTAR CREN KHKVGSFCKY KCKPGYHVPG SSRKSKKRAF KTQCTQDGSW QEGACVPVTC DPPPPKFHGL YQCTNGFQFN SECRIK CED SDASQGLGSN VIHCRKDGTW NGSFHVCQEM QGQCSVPNEL NSNLKLQCPD GYAIGSECAT SCLDHNSESI ILPMNVT VR DIPHWLNPTR VERVVCTAGL KWYPHPALIH CVKGCEPFMG DNYCDAINNR AFCNYDGGDC CTSTVKTKKV TPFPMSCD L QGDCACRDPQ AQEHS UniProtKB: Pappalysin-1 |
-分子 #3: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 3 / コピー数: 2 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-分子 #4: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 4 / コピー数: 16 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.6 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
詳細: HEPES buffer 20 mM Hepes pH 7.5 100 mM NaCl, 1mM CaCl | ||||||||||||
| グリッド | モデル: C-flat-2/2 / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 277.15 K / 装置: LEICA EM GP / 詳細: Blot time 4.5 sec. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | #0 - Image recording ID: 1 #0 - フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) #0 - 撮影したグリッド数: 1 / #0 - 実像数: 10060 / #0 - 平均露光時間: 0.8 sec. / #0 - 平均電子線量: 58.0 e/Å2 / #1 - Image recording ID: 2 #1 - フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) #1 - 撮影したグリッド数: 1 / #1 - 実像数: 32144 / #1 - 平均露光時間: 0.91 sec. / #1 - 平均電子線量: 59.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 0.6 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 詳細 | Initial model source: alphafold2 models PAPP-A AF-Q13219-F1 STC2 AF-O76061-F1 |
|---|---|
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
| 得られたモデル |  PDB-8a7e: |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)