+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | (h-alpha2M)4 transient III state | |||||||||||||||
 マップデータ マップデータ | (h-alpha2M)4 transient III state | |||||||||||||||
 試料 試料 |
| |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 9.1 Å | |||||||||||||||
 データ登録者 データ登録者 | Luque D / Goulas T / Mata CP / Mendes SR / Gomis-Ruth FX / Caston JR | |||||||||||||||
| 資金援助 |  スペイン, 4件 スペイン, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2022 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022タイトル: Cryo-EM structures show the mechanistic basis of pan-peptidase inhibition by human α-macroglobulin. 著者: Daniel Luque / Theodoros Goulas / Carlos P Mata / Soraia R Mendes / F Xavier Gomis-Rüth / José R Castón /    要旨: Human α2-macroglobulin (hα2M) is a multidomain protein with a plethora of essential functions, including transport of signaling molecules and endopeptidase inhibition in innate immunity. Here, we ...Human α2-macroglobulin (hα2M) is a multidomain protein with a plethora of essential functions, including transport of signaling molecules and endopeptidase inhibition in innate immunity. Here, we dissected the molecular mechanism of the inhibitory function of the ∼720-kDa hα2M tetramer through eight cryo–electron microscopy (cryo-EM) structures of complexes from human plasma. In the native complex, the hα2M subunits are organized in two flexible modules in expanded conformation, which enclose a highly porous cavity in which the proteolytic activity of circulating plasma proteins is tested. Cleavage of bait regions exposed inside the cavity triggers rearrangement to a compact conformation, which closes openings and entraps the prey proteinase. After the expanded-to-compact transition, which occurs independently in the four subunits, the reactive thioester bond triggers covalent linking of the proteinase, and the receptor-binding domain is exposed on the tetramer surface for receptor-mediated clearance from circulation. These results depict the molecular mechanism of a unique suicidal inhibitory trap. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
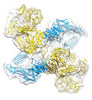
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12943.map.gz emd_12943.map.gz | 13 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12943-v30.xml emd-12943-v30.xml emd-12943.xml emd-12943.xml | 13.6 KB 13.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_12943.png emd_12943.png | 186.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12943 http://ftp.pdbj.org/pub/emdb/structures/EMD-12943 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12943 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12943 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12943_validation.pdf.gz emd_12943_validation.pdf.gz | 304.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12943_full_validation.pdf.gz emd_12943_full_validation.pdf.gz | 304.3 KB | 表示 | |
| XML形式データ |  emd_12943_validation.xml.gz emd_12943_validation.xml.gz | 6.5 KB | 表示 | |
| CIF形式データ |  emd_12943_validation.cif.gz emd_12943_validation.cif.gz | 7.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12943 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12943 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12943 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12943 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12943.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12943.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | (h-alpha2M)4 transient III state | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.047 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Human alpha-2-macroglobulin transient III state
| 全体 | 名称: Human alpha-2-macroglobulin transient III state |
|---|---|
| 要素 |
|
-超分子 #1: Human alpha-2-macroglobulin transient III state
| 超分子 | 名称: Human alpha-2-macroglobulin transient III state / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 器官: Blood plasma Homo sapiens (ヒト) / 器官: Blood plasma |
| 分子量 | 理論値: 700 KDa |
-分子 #1: Alpha-2-macroglobulin
| 分子 | 名称: Alpha-2-macroglobulin / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MGKNKLLHPS LVLLLLVLLP TDASVSGKPQ YMVLVPSLLH TETTEKGCVL LSYLNETVTV SASLESVRG NRSLFTDLEA ENDVLHCVAF AVPKSSSNEE VMFLTVQVKG PTQEFKKRTT V MVKNEDSL VFVQTDKSIY KPGQTVKFRV VSMDENFHPL NELIPLVYIQ ...文字列: MGKNKLLHPS LVLLLLVLLP TDASVSGKPQ YMVLVPSLLH TETTEKGCVL LSYLNETVTV SASLESVRG NRSLFTDLEA ENDVLHCVAF AVPKSSSNEE VMFLTVQVKG PTQEFKKRTT V MVKNEDSL VFVQTDKSIY KPGQTVKFRV VSMDENFHPL NELIPLVYIQ DPKGNRIAQW QS FQLEGGL KQFSFPLSSE PFQGSYKVVV QKKSGGRTEH PFTVEEFVLP KFEVQVTVPK IIT ILEEEM NVSVCGLYTY GKPVPGHVTV SICRKYSDAS DCHGEDSQAF CEKFSGQLNS HGCF YQQVK TKVFQLKRKE YEMKLHTEAQ IQEEGTVVEL TGRQSSEITR TITKLSFVKV DSHFR QGIP FFGQVRLVDG KGVPIPNKVI FIRGNEANYY SNATTDEHGL VQFSINTTNV MGTSLT VRV NYKDRSPCYG YQWVSEEHEE AHHTAYLVFS PSKSFVHLEP MSHELPCGHT QTVQAHY IL NGGTLLGLKK LSFYYLIMAK GGIVRTGTHG LLVKQEDMKG HFSISIPVKS DIAPVARL L IYAVLPTGDV IGDSAKYDVE NCLANKVDLS FSPSQSLPAS HAHLRVTAAP QSVCALRAV DQSVLLMKPD AELSASSVYN LLPEKDLTGF PGPLNDQDNE DCINRHNVYI NGITYTPVSS TNEKDMYSF LEDMGLKAFT NSKIRKPKMC PQLQQYEMHG PEGLRVGFYE SDVMGRGHAR L VHVEEPHT ETVRKYFPET WIWDLVVVNS AGVAEVGVTV PDTITEWKAG AFCLSEDAGL GI SSTASLR AFQPFFVELT MPYSVIRGEA FTLKATVLNY LPKCIRVSVQ LEASPAFLAV PVE KEQAPH CICANGRQTV SWAVTPKSLG NVNFTVSAEA LESQELCGTE VPSVPEHGRK DTVI KPLLV EPEGLEKETT FNSLLCPSGG EVSEELSLKL PPNVVEESAR ASVSVLGDIL GSAMQ NTQN LLQMPYGCGE QNMVLFAPNI YVLDYLNETQ QLTPEIKSKA IGYLNTGYQR QLNYKH YDG SYSTFGERYG RNQGNTWLTA FVLKTFAQAR AYIFIDEAHI TQALIWLSQR QKDNGCF RS SGSLLNNAIK GGVEDEVTLS AYITIALLEI PLTVTHPVVR NALFCLESAW KTAQEGDH G SHVYTKALLA YAFALAGNQD KRKEVLKSLN EEAVKKDNSV HWERPQKPKA PVGHFYEPQ APSAEVEMTS YVLLAYLTAQ PAPTSEDLTS ATNIVKWITK QQNAQGGFSS TQDTVVALHA LSKYGAATF TRTGKAAQVT IQSSGTFSSK FQVDNNNRLL LQQVSLPELP GEYSMKVTGE G CVYLQTSL KYNILPEKEE FPFALGVQTL PQTCDEPKAH TSFQISLSVS YTGSRSASNM AI VDVKMVS GFIPLKPTVK MLERSNHVSR TEVSSNHVLI YLDKVSNQTL SLFFTVLQDV PVR DLKPAI VKVYDYYETD EFAIAEYNAP CSKDLGNA |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER/RHODIUM |
| 凍結 | 凍結剤: ETHANE / 装置: LEICA EM CPC |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 実像数: 12143 / 平均電子線量: 39.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.25 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 47775 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: OTHER |
|---|
 ムービー
ムービー コントローラー
コントローラー






















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)