+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-12602 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human Pol Kappa holoenzyme with Ub-PCNA | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Translesion synthesis / TLS / REPLICATION | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of deoxyribonuclease activity / dinucleotide insertion or deletion binding / PCNA-p21 complex / mitotic telomere maintenance via semi-conservative replication / purine-specific mismatch base pair DNA N-glycosylase activity / nucleotide-excision repair, DNA gap filling / nuclear lamina / positive regulation of DNA-directed DNA polymerase activity / Polymerase switching / Telomere C-strand (Lagging Strand) Synthesis ...positive regulation of deoxyribonuclease activity / dinucleotide insertion or deletion binding / PCNA-p21 complex / mitotic telomere maintenance via semi-conservative replication / purine-specific mismatch base pair DNA N-glycosylase activity / nucleotide-excision repair, DNA gap filling / nuclear lamina / positive regulation of DNA-directed DNA polymerase activity / Polymerase switching / Telomere C-strand (Lagging Strand) Synthesis / MutLalpha complex binding / Processive synthesis on the lagging strand / PCNA complex / Removal of the Flap Intermediate / Processive synthesis on the C-strand of the telomere / Polymerase switching on the C-strand of the telomere / Removal of the Flap Intermediate from the C-strand / Mismatch repair (MMR) directed by MSH2:MSH3 (MutSbeta) / Mismatch repair (MMR) directed by MSH2:MSH6 (MutSalpha) / Transcription of E2F targets under negative control by DREAM complex / replisome / response to L-glutamate / histone acetyltransferase binding / DNA polymerase processivity factor activity / leading strand elongation / G1/S-Specific Transcription / response to dexamethasone / replication fork processing / nuclear replication fork / SUMOylation of DNA replication proteins / PCNA-Dependent Long Patch Base Excision Repair / error-prone translesion synthesis / mismatch repair / translesion synthesis / response to cadmium ion / cyclin-dependent protein kinase holoenzyme complex / estrous cycle / base-excision repair, gap-filling / DNA polymerase binding / epithelial cell differentiation / positive regulation of DNA repair / male germ cell nucleus / TP53 Regulates Transcription of Genes Involved in G2 Cell Cycle Arrest / Translesion synthesis by REV1 / Translesion synthesis by POLK / liver regeneration / Translesion synthesis by POLI / replication fork / Gap-filling DNA repair synthesis and ligation in GG-NER / positive regulation of DNA replication / nuclear estrogen receptor binding / Termination of translesion DNA synthesis / Recognition of DNA damage by PCNA-containing replication complex / Translesion Synthesis by POLH / receptor tyrosine kinase binding / HDR through Homologous Recombination (HRR) / Dual Incision in GG-NER / cellular response to hydrogen peroxide / Dual incision in TC-NER / Gap-filling DNA repair synthesis and ligation in TC-NER / cellular response to UV / cellular response to xenobiotic stimulus / E3 ubiquitin ligases ubiquitinate target proteins / response to estradiol / heart development / DNA-directed DNA polymerase / damaged DNA binding / DNA-directed DNA polymerase activity / chromosome, telomeric region / DNA replication / nuclear body / DNA repair / centrosome / DNA damage response / chromatin binding / protein-containing complex binding / chromatin / enzyme binding / negative regulation of transcription by RNA polymerase II / extracellular exosome / zinc ion binding / nucleoplasm / identical protein binding / nucleus 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / synthetic construct (人工物) Homo sapiens (ヒト) / synthetic construct (人工物) | |||||||||
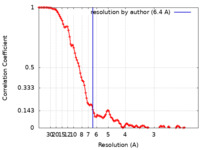
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 6.4 Å | |||||||||
 データ登録者 データ登録者 | Lancey C / De Biasio A | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Cryo-EM structure of human Pol κ bound to DNA and mono-ubiquitylated PCNA. 著者: Claudia Lancey / Muhammad Tehseen / Souvika Bakshi / Matthew Percival / Masateru Takahashi / Mohamed A Sobhy / Vlad S Raducanu / Kerry Blair / Frederick W Muskett / Timothy J Ragan / Ramon ...著者: Claudia Lancey / Muhammad Tehseen / Souvika Bakshi / Matthew Percival / Masateru Takahashi / Mohamed A Sobhy / Vlad S Raducanu / Kerry Blair / Frederick W Muskett / Timothy J Ragan / Ramon Crehuet / Samir M Hamdan / Alfredo De Biasio /    要旨: Y-family DNA polymerase κ (Pol κ) can replicate damaged DNA templates to rescue stalled replication forks. Access of Pol κ to DNA damage sites is facilitated by its interaction with the ...Y-family DNA polymerase κ (Pol κ) can replicate damaged DNA templates to rescue stalled replication forks. Access of Pol κ to DNA damage sites is facilitated by its interaction with the processivity clamp PCNA and is regulated by PCNA mono-ubiquitylation. Here, we present cryo-EM reconstructions of human Pol κ bound to DNA, an incoming nucleotide, and wild type or mono-ubiquitylated PCNA (Ub-PCNA). In both reconstructions, the internal PIP-box adjacent to the Pol κ Polymerase-Associated Domain (PAD) docks the catalytic core to one PCNA protomer in an angled orientation, bending the DNA exiting the Pol κ active site through PCNA, while Pol κ C-terminal domain containing two Ubiquitin Binding Zinc Fingers (UBZs) is invisible, in agreement with disorder predictions. The ubiquitin moieties are partly flexible and extend radially away from PCNA, with the ubiquitin at the Pol κ-bound protomer appearing more rigid. Activity assays suggest that, when the internal PIP-box interaction is lost, Pol κ is retained on DNA by a secondary interaction between the UBZs and the ubiquitins flexibly conjugated to PCNA. Our data provide a structural basis for the recruitment of a Y-family TLS polymerase to sites of DNA damage. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12602.map.gz emd_12602.map.gz | 8.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12602-v30.xml emd-12602-v30.xml emd-12602.xml emd-12602.xml | 20.4 KB 20.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_12602_fsc.xml emd_12602_fsc.xml | 13.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_12602.png emd_12602.png | 62.1 KB | ||
| Filedesc metadata |  emd-12602.cif.gz emd-12602.cif.gz | 7.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12602 http://ftp.pdbj.org/pub/emdb/structures/EMD-12602 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12602 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12602 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12602_validation.pdf.gz emd_12602_validation.pdf.gz | 459.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12602_full_validation.pdf.gz emd_12602_full_validation.pdf.gz | 459 KB | 表示 | |
| XML形式データ |  emd_12602_validation.xml.gz emd_12602_validation.xml.gz | 10 KB | 表示 | |
| CIF形式データ |  emd_12602_validation.cif.gz emd_12602_validation.cif.gz | 13.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12602 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12602 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12602 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12602 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7nv1MC  7nv0C C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10934 (タイトル: Cryo-EM multiframe micrographs of human Pol kappa complexed with DNA and monoubiquitylated PCNA EMPIAR-10934 (タイトル: Cryo-EM multiframe micrographs of human Pol kappa complexed with DNA and monoubiquitylated PCNAData size: 1.9 TB Data #1: Multiframe micrographs of human Pol κ complexed with monoubiquitylated PCNA and DNA [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12602.map.gz / 形式: CCP4 / 大きさ: 9.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12602.map.gz / 形式: CCP4 / 大きさ: 9.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
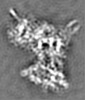
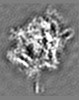
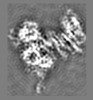
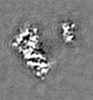
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.086 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
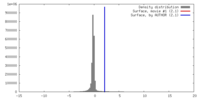
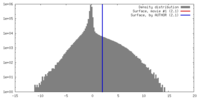
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Pol kappa holoenzyme with Ub-PCNA
| 全体 | 名称: Pol kappa holoenzyme with Ub-PCNA |
|---|---|
| 要素 |
|
-超分子 #1: Pol kappa holoenzyme with Ub-PCNA
| 超分子 | 名称: Pol kappa holoenzyme with Ub-PCNA / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 |
|---|---|
| 分子量 | 理論値: 232 KDa |
-超分子 #2: Pol kappa holoenzyme
| 超分子 | 名称: Pol kappa holoenzyme / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #3: DNA
| 超分子 | 名称: DNA / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #3-#4 |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
-分子 #1: Proliferating cell nuclear antigen
| 分子 | 名称: Proliferating cell nuclear antigen / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 29.088061 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GPHMFEARLV QGSILKKVLE ALKDLINEAC WDISSSGVNL QSMDSSHVSL VQLTLRSEGF DTYRCDRNLA MGVNLTSMSK ILKCAGNED IITLRAEDNA DTLALVFEAP NQEKVSDYEM KLMDLDVEQL GIPEQEYSCV VKMPSGEFAR ICRDLSHIGD A VVISCAKD ...文字列: GPHMFEARLV QGSILKKVLE ALKDLINEAC WDISSSGVNL QSMDSSHVSL VQLTLRSEGF DTYRCDRNLA MGVNLTSMSK ILKCAGNED IITLRAEDNA DTLALVFEAP NQEKVSDYEM KLMDLDVEQL GIPEQEYSCV VKMPSGEFAR ICRDLSHIGD A VVISCAKD GVKFSASGEL GNGNIKLSQT SNVDKEEEAV TIEMNEPVQL TFALRYLNFF TKATPLSSTV TLSMSADVPL VV EYKIADM GHLKYYLAPK IEDEEGS UniProtKB: Proliferating cell nuclear antigen |
-分子 #2: DNA polymerase kappa
| 分子 | 名称: DNA polymerase kappa / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO / EC番号: DNA-directed DNA polymerase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 98.952695 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDSTKEKCDS YKDDLLLRMG LNDNKAGMEG LDKEKINKII MEATKGSRFY GNELKKEKQV NQRIENMMQQ KAQITSQQLR KAQLQVDRF AMELEQSRNL SNTIVHIDMD AFYAAVEMRD NPELKDKPIA VGSMSMLSTS NYHARRFGVR AAMPGFIAKR L CPQLIIVP ...文字列: MDSTKEKCDS YKDDLLLRMG LNDNKAGMEG LDKEKINKII MEATKGSRFY GNELKKEKQV NQRIENMMQQ KAQITSQQLR KAQLQVDRF AMELEQSRNL SNTIVHIDMD AFYAAVEMRD NPELKDKPIA VGSMSMLSTS NYHARRFGVR AAMPGFIAKR L CPQLIIVP PNFDKYRAVS KEVKEILADY DPNFMAMSLD EAYLNITKHL EERQNWPEDK RRYFIKMGSS VENDNPGKEV NK LSEHERS ISPLLFEESP SDVQPPGDPF QVNFEEQNNP QILQNSVVFG TSAQEVVKEI RFRIEQKTTL TASAGIAPNT MLA KVCSDK NKPNGQYQIL PNRQAVMDFI KDLPIRKVSG IGKVTEKMLK ALGIITCTEL YQQRALLSLL FSETSWHYFL HISL GLGST HLTRDGERKS MSVERTFSEI NKAEEQYSLC QELCSELAQD LQKERLKGRT VTIKLKNVNF EVKTRASTVS SVVST AEEI FAIAKELLKT EIDADFPHPL RLRLMGVRIS SFPNEEDRKH QQRSIIGFLQ AGNQALSATE CTLEKTDKDK FVKPLE MSH KKSFFDKKRS ERKWSHQDTF KCEAVNKQSF QTSQPFQVLK KKMNENLEIS ENSDDCQILT CPVCFRAQGC ISLEALN KH VDECLDGPSI SENFKMFSCS HVSATKVNKK ENVPASSLCE KQDYEAHPKI KEISSVDCIA LVDTIDNSSK AESIDALS N KHSKEECSSL PSKSFNIEHC HQNSSSTVSL ENEDVGSFRQ EYRQPYLCEV KTGQALVCPV CNVEQKTSDL TLFNVHVDV CLNKSFIQEL RKDKFNPVNQ PKESSRSTGS SSGVQKAVTR TKRPGLMTKY STSKKIKPNN PKHTLDIFFK UniProtKB: DNA polymerase kappa |
-分子 #3: DNA Primer
| 分子 | 名称: DNA Primer / タイプ: dna / ID: 3 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 7.665987 KDa |
| 配列 | 文字列: (DA)(DG)(DC)(DT)(DA)(DT)(DG)(DA)(DC)(DC) (DA)(DT)(DG)(DA)(DT)(DT)(DA)(DC)(DG)(DA) (DA)(DT)(DT)(DG)(DOC) |
-分子 #4: DNA Template
| 分子 | 名称: DNA Template / タイプ: dna / ID: 4 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 11.677539 KDa |
| 配列 | 文字列: (DC)(DT)(DG)(DC)(DA)(DC)(DG)(DA)(DA)(DT) (DT)(DA)(DA)(DG)(DC)(DA)(DA)(DT)(DT)(DC) (DG)(DT)(DA)(DA)(DT)(DC)(DA)(DT)(DG) (DG)(DT)(DC)(DA)(DT)(DA)(DG)(DC)(DT) |
-分子 #5: THYMIDINE-5'-TRIPHOSPHATE
| 分子 | 名称: THYMIDINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 1 / 式: TTP |
|---|---|
| 分子量 | 理論値: 482.168 Da |
| Chemical component information |  ChemComp-TTP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 300 sec. / 詳細: 40 mA | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 77.0 K / 最高: 77.0 K |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 11520 pixel / デジタル化 - サイズ - 縦: 8184 pixel / 撮影したグリッド数: 1 / 実像数: 3889 / 平均露光時間: 5.0 sec. / 平均電子線量: 47.0 e/Å2 / 詳細: Super resolution mode & AFIS used |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: RIGID BODY FIT |
|---|---|
| 得られたモデル |  PDB-7nv1: |
 ムービー
ムービー コントローラー
コントローラー































 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)