機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / /  データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報
 データ登録者
データ登録者 英国, 3件
英国, 3件  引用
引用 ジャーナル: Nat Commun / 年: 2020
ジャーナル: Nat Commun / 年: 2020


 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_11425.map.gz
emd_11425.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-11425-v30.xml
emd-11425-v30.xml emd-11425.xml
emd-11425.xml EMDBヘッダ
EMDBヘッダ emd_11425_fsc.xml
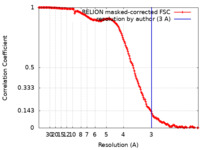
emd_11425_fsc.xml FSCデータファイル
FSCデータファイル emd_11425.png
emd_11425.png emd_11425_msk_1.map
emd_11425_msk_1.map マスクマップ
マスクマップ emd_11425_half_map_1.map.gz
emd_11425_half_map_1.map.gz emd_11425_half_map_2.map.gz
emd_11425_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-11425
http://ftp.pdbj.org/pub/emdb/structures/EMD-11425 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11425
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11425 emd_11425_validation.pdf.gz
emd_11425_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_11425_full_validation.pdf.gz
emd_11425_full_validation.pdf.gz emd_11425_validation.xml.gz
emd_11425_validation.xml.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11425
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11425 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11425
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11425 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_11425.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_11425.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) emd_11425_msk_1.map
emd_11425_msk_1.map 試料の構成要素
試料の構成要素
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー












































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)