+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10389 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the RsaA N-terminal domain bound to LPS | |||||||||
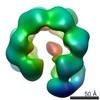
 マップデータ マップデータ | cryo-EM map of the RsaA protein N-terminal domain | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | S-layer LPS RsaA / STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 | RsaA N-terminal domain / S-layer / RTX calcium-binding nonapeptide repeat / RTX calcium-binding nonapeptide repeat (4 copies) / Serralysin-like metalloprotease, C-terminal / calcium ion binding / extracellular region / S-layer protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Caulobacter vibrioides CB15 (バクテリア) Caulobacter vibrioides CB15 (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.7 Å | |||||||||
 データ登録者 データ登録者 | von Kuegelgen A / Bharat TAM | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2020 ジャーナル: Cell / 年: 2020タイトル: In Situ Structure of an Intact Lipopolysaccharide-Bound Bacterial Surface Layer. 著者: Andriko von Kügelgen / Haiping Tang / Gail G Hardy / Danguole Kureisaite-Ciziene / Yves V Brun / Phillip J Stansfeld / Carol V Robinson / Tanmay A M Bharat /    要旨: Most bacterial and all archaeal cells are encapsulated by a paracrystalline, protective, and cell-shape-determining proteinaceous surface layer (S-layer). On Gram-negative bacteria, S-layers are ...Most bacterial and all archaeal cells are encapsulated by a paracrystalline, protective, and cell-shape-determining proteinaceous surface layer (S-layer). On Gram-negative bacteria, S-layers are anchored to cells via lipopolysaccharide. Here, we report an electron cryomicroscopy structure of the Caulobacter crescentus S-layer bound to the O-antigen of lipopolysaccharide. Using native mass spectrometry and molecular dynamics simulations, we deduce the length of the O-antigen on cells and show how lipopolysaccharide binding and S-layer assembly is regulated by calcium. Finally, we present a near-atomic resolution in situ structure of the complete S-layer using cellular electron cryotomography, showing S-layer arrangement at the tip of the O-antigen. A complete atomic structure of the S-layer shows the power of cellular tomography for in situ structural biology and sheds light on a very abundant class of self-assembling molecules with important roles in prokaryotic physiology with marked potential for synthetic biology and surface-display applications. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10389.map.gz emd_10389.map.gz | 95.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10389-v30.xml emd-10389-v30.xml emd-10389.xml emd-10389.xml | 18.9 KB 18.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_10389.png emd_10389.png | 19.1 KB | ||
| Filedesc metadata |  emd-10389.cif.gz emd-10389.cif.gz | 7.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10389 http://ftp.pdbj.org/pub/emdb/structures/EMD-10389 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10389 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10389 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10389_validation.pdf.gz emd_10389_validation.pdf.gz | 634.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10389_full_validation.pdf.gz emd_10389_full_validation.pdf.gz | 634.1 KB | 表示 | |
| XML形式データ |  emd_10389_validation.xml.gz emd_10389_validation.xml.gz | 6.2 KB | 表示 | |
| CIF形式データ |  emd_10389_validation.cif.gz emd_10389_validation.cif.gz | 7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10389 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10389 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10389 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10389 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10389.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10389.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | cryo-EM map of the RsaA protein N-terminal domain | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Structure of RsaA N-terminal domain bound to LPS
| 全体 | 名称: Structure of RsaA N-terminal domain bound to LPS |
|---|---|
| 要素 |
|
-超分子 #1: Structure of RsaA N-terminal domain bound to LPS
| 超分子 | 名称: Structure of RsaA N-terminal domain bound to LPS / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 / 詳細: Structure of RsaA N-terminal domain bound to LPS |
|---|---|
| 由来(天然) | 生物種:  Caulobacter vibrioides CB15 (バクテリア) / 株: YB1001 Caulobacter vibrioides CB15 (バクテリア) / 株: YB1001 |
| 分子量 | 理論値: 577 KDa |
-分子 #1: S-layer protein
| 分子 | 名称: S-layer protein / タイプ: protein_or_peptide / ID: 1 / 詳細: LPS O-antigen bound to protein / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Caulobacter vibrioides CB15 (バクテリア) Caulobacter vibrioides CB15 (バクテリア) |
| 分子量 | 理論値: 25.820354 KDa |
| 組換発現 | 生物種:  Caulobacter vibrioides CB15 (バクテリア) Caulobacter vibrioides CB15 (バクテリア) |
| 配列 | 文字列: AYTTAQLVTA YTNANLGKAP DAATTLTLDA YATQTQTGGL SDAAALTNTL KLVNSTTAVA IQTYQFFTGV APSAAGLDFL VDSTTNTND LNDAYYSKFA QENRFINFSI NLATGAGAGA TAFAAAYTGV SYAQTVATAY DKIIGNAVAT AAGVDVAAAV A FLSRQANI ...文字列: AYTTAQLVTA YTNANLGKAP DAATTLTLDA YATQTQTGGL SDAAALTNTL KLVNSTTAVA IQTYQFFTGV APSAAGLDFL VDSTTNTND LNDAYYSKFA QENRFINFSI NLATGAGAGA TAFAAAYTGV SYAQTVATAY DKIIGNAVAT AAGVDVAAAV A FLSRQANI DYLTAFVRAN TPFTAAADID LAVKAALIGT ILNAATVSGI GGYATATAAM INDLSDGALS TDNAAGVNLF TA YPSSGVS GSENLYFQ UniProtKB: S-layer protein |
-分子 #3: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 3 / コピー数: 3 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.5 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: Buffer solutions were prepared fresh from sterile filtered concentrated stocksolutions. Solutions were filtered through a 0.22 um filter to avoid microbial contamination and degassed using a ...詳細: Buffer solutions were prepared fresh from sterile filtered concentrated stocksolutions. Solutions were filtered through a 0.22 um filter to avoid microbial contamination and degassed using a vacuum fold pump. The pH of the HEPES stock solution was adjusted with sodium hydroxide at 4 deg C. | |||||||||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER/RHODIUM / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. / 前処理 - 雰囲気: AIR / 詳細: 20 seconds, 15 mA | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 283.15 K / 装置: FEI VITROBOT MARK IV 詳細: Vitrobot options: Blot time 3 seconds, Blot force -13,1, Wait time 10 seconds, Drain time 0.5 seconds,. | |||||||||||||||
| 詳細 | RsaA N-terminal domain with LPS |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 70.0 K / 最高: 70.0 K |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 詳細 | EPU software |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / デジタル化 - 画像ごとのフレーム数: 1-20 / 撮影したグリッド数: 1 / 実像数: 2422 / 平均露光時間: 8.0 sec. / 平均電子線量: 43.0 e/Å2 詳細: Images were collected in movie-mode and subjected to 8 seconds of exposure where a total dose of 43 e-/A2 was applied, and 20 frames were recorded per movie. |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 最大 デフォーカス(補正後): -4.0 µm / 最小 デフォーカス(補正後): -1.0 µm / 倍率(補正後): 130000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): -4.0 µm / 最小 デフォーカス(公称値): -1.0 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 詳細 | The carbon backbone of the RsaA protein was manually traced through a single subunit of the cryo-EM density using Coot (Emsley et al., 2010). Initially, side chains were assigned in regions with density corresponding to characteristic aromatic residues allowing us to deduce the register of the amino acid sequence in the map. Side chains for residues 2-243 of RsaA were thus assigned unambiguously and the structure was refined and manually rebuilt using Refmac5 (Murshudov et al., 2011) inside the CCP-EM (Burnley et al., 2017) software suite and Coot. |
|---|---|
| 精密化 | 空間: RECIPROCAL / プロトコル: BACKBONE TRACE / 温度因子: 85.819 / 当てはまり具合の基準: Best fit |
| 得られたモデル |  PDB-6t72: |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















