+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 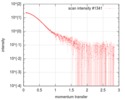 |
|---|---|
 試料 試料 | Cytokine-like nuclear factor dehydrogenase domain, NPAC DH, plus native linker (NPAC delta-205)
|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報chromatin-protein adaptor activity / transcription elongation-coupled chromatin remodeling / nucleosome binding / transcription initiation-coupled chromatin remodeling / NAD binding / nucleosome / NADP binding / histone binding / chromatin binding / chromatin ...chromatin-protein adaptor activity / transcription elongation-coupled chromatin remodeling / nucleosome binding / transcription initiation-coupled chromatin remodeling / NAD binding / nucleosome / NADP binding / histone binding / chromatin binding / chromatin / DNA binding / nucleoplasm / cytosol 類似検索 - 分子機能 |
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
 引用 引用 |  ジャーナル: Cell Rep / 年: 2019 ジャーナル: Cell Rep / 年: 2019タイトル: A Tail-Based Mechanism Drives Nucleosome Demethylation by the LSD2/NPAC Multimeric Complex. 著者: Chiara Marabelli / Biagina Marrocco / Simona Pilotto / Sagar Chittori / Sarah Picaud / Sara Marchese / Giuseppe Ciossani / Federico Forneris / Panagis Filippakopoulos / Guy Schoehn / Daniela ...著者: Chiara Marabelli / Biagina Marrocco / Simona Pilotto / Sagar Chittori / Sarah Picaud / Sara Marchese / Giuseppe Ciossani / Federico Forneris / Panagis Filippakopoulos / Guy Schoehn / Daniela Rhodes / Sriram Subramaniam / Andrea Mattevi /       要旨: LSD1 and LSD2 are homologous histone demethylases with opposite biological outcomes related to chromatin silencing and transcription elongation, respectively. Unlike LSD1, LSD2 nucleosome-demethylase ...LSD1 and LSD2 are homologous histone demethylases with opposite biological outcomes related to chromatin silencing and transcription elongation, respectively. Unlike LSD1, LSD2 nucleosome-demethylase activity relies on a specific linker peptide from the multidomain protein NPAC. We used single-particle cryoelectron microscopy (cryo-EM), in combination with kinetic and mutational analysis, to analyze the mechanisms underlying the function of the human LSD2/NPAC-linker/nucleosome complex. Weak interactions between LSD2 and DNA enable multiple binding modes for the association of the demethylase to the nucleosome. The demethylase thereby captures mono- and dimethyl Lys4 of the H3 tail to afford histone demethylation. Our studies also establish that the dehydrogenase domain of NPAC serves as a catalytically inert oligomerization module. While LSD1/CoREST forms a nucleosome docking platform at silenced gene promoters, LSD2/NPAC is a multifunctional enzyme complex with flexible linkers, tailored for rapid chromatin modification, in conjunction with the advance of the RNA polymerase on actively transcribed genes. |
 登録者 登録者 |
|
- 構造の表示
構造の表示
- ダウンロードとリンク
ダウンロードとリンク
-Data source
| SASBDBのページ |  SASDFW3 SASDFW3 |
|---|
-関連構造データ
- 外部リンク
外部リンク
| 「今月の分子」の関連する項目 |
|---|
-モデル
- 試料
試料
 試料 試料 | 名称: Cytokine-like nuclear factor dehydrogenase domain, NPAC DH, plus native linker (NPAC delta-205) 試料濃度: 1.25 mg/ml |
|---|---|
| バッファ | 名称: 15 mM HEPES, 200 mM NaCl / pH: 7.3 |
| 要素 #1519 | 名称: NPAC delta205 / タイプ: protein / 記述: NPAC linker+DH (delta-205) / 分子量: 37.438 / 分子数: 4 / 由来: Homo sapiens / 参照: UniProt: Q49A26 配列: TASEPVKDAD PHFHHFLLSQ TEKPAVCYQA ITKKLKICEE ETGSTSIQAA DSTAVNGSIT PTDKKIGFLG LGLMGSGIVS NLLKMGHTVT VWNRTAEKCD LFIQEGARLG RTPAEVVSTC DITFACVSDP KAAKDLVLGP SGVLQGIRPG KCYVDMSTVD ADTVTELAQV ...配列: TASEPVKDAD PHFHHFLLSQ TEKPAVCYQA ITKKLKICEE ETGSTSIQAA DSTAVNGSIT PTDKKIGFLG LGLMGSGIVS NLLKMGHTVT VWNRTAEKCD LFIQEGARLG RTPAEVVSTC DITFACVSDP KAAKDLVLGP SGVLQGIRPG KCYVDMSTVD ADTVTELAQV IVSRGGRFLE APVSGNQQLS NDGMLVILAA GDRGLYEDCS SCFQAMGKTS FFLGEVGNAA KMMLIVNMVQ GSFMATIAEG LTLAQVTGQS QQTLLDILNQ GQLASIFLDQ KCQNILQGNF KPDFYLKYIQ KDLRLAIALG DAVNHPTPMA AAANEVYKRA KALDQSDNDM SAVYRAYIH |
-実験情報
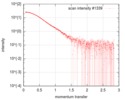
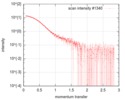
| ビーム | 設備名称: ESRF BM29 / 地域: Grenoble / 国: France  / 線源: X-ray synchrotron / 波長: 0.1 Å / スペクトロメータ・検出器間距離: 2.87 mm / 線源: X-ray synchrotron / 波長: 0.1 Å / スペクトロメータ・検出器間距離: 2.87 mm | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 検出器 | 名称: Pilatus 1M / タイプ: Dectris / Pixsize x: 172 mm | ||||||||||||||||||||||||||||||
| スキャン | 測定日: 2018年1月26日 / 保管温度: 4 °C / セル温度: 20 °C / 照射時間: 1 sec. / フレーム数: 222 / 単位: 1/nm /
| ||||||||||||||||||||||||||||||
| 距離分布関数 P(R) |
| ||||||||||||||||||||||||||||||
| 結果 | コメント: The protein construct encompasses the dehydrogenase domain plus an additional upstream native-sequence amino acid linker (compare to the isolated dehydrogenase domain, SASDFV3, NPAC delta-261).
|
 ムービー
ムービー コントローラー
コントローラー