+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8jpe | ||||||
|---|---|---|---|---|---|---|---|
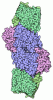
| タイトル | Focused refinement structure of Galpha(q) in NTSR1-GRK2-Galpha(q) complexes | ||||||
 要素 要素 | Guanine nucleotide-binding protein G(q) subunit alpha | ||||||
 キーワード キーワード | SIGNALING PROTEIN / Biased signaling | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Fatty Acids bound to GPR40 (FFAR1) regulate insulin secretion / Acetylcholine regulates insulin secretion / PLC beta mediated events / phospholipase C-activating dopamine receptor signaling pathway / entrainment of circadian clock / regulation of platelet activation / phototransduction, visible light / regulation of canonical Wnt signaling pathway / glutamate receptor signaling pathway / action potential ...Fatty Acids bound to GPR40 (FFAR1) regulate insulin secretion / Acetylcholine regulates insulin secretion / PLC beta mediated events / phospholipase C-activating dopamine receptor signaling pathway / entrainment of circadian clock / regulation of platelet activation / phototransduction, visible light / regulation of canonical Wnt signaling pathway / glutamate receptor signaling pathway / action potential / photoreceptor outer segment / GTPase activator activity / G protein-coupled receptor binding / negative regulation of protein kinase activity / G-protein beta/gamma-subunit complex binding / adenylate cyclase-activating G protein-coupled receptor signaling pathway / Thromboxane signalling through TP receptor / G protein-coupled acetylcholine receptor signaling pathway / G-protein activation / ADP signalling through P2Y purinoceptor 1 / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / blood coagulation / heterotrimeric G-protein complex / Thrombin signalling through proteinase activated receptors (PARs) / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / nuclear membrane / G alpha (q) signalling events / protein stabilization / lysosomal membrane / GTPase activity / synapse / GTP binding / Golgi apparatus / extracellular exosome / metal ion binding / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.91 Å | ||||||
 データ登録者 データ登録者 | Duan, J. / Liu, H. / Zhao, F. / Yuan, Q. / Ji, Y. / Xu, H.E. | ||||||
| 資金援助 |  中国, 1件 中国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: GPCR activation and GRK2 assembly by a biased intracellular agonist. 著者: Jia Duan / Heng Liu / Fenghui Zhao / Qingning Yuan / Yujie Ji / Xiaoqing Cai / Xinheng He / Xinzhu Li / Junrui Li / Kai Wu / Tianyu Gao / Shengnan Zhu / Shi Lin / Ming-Wei Wang / Xi Cheng / ...著者: Jia Duan / Heng Liu / Fenghui Zhao / Qingning Yuan / Yujie Ji / Xiaoqing Cai / Xinheng He / Xinzhu Li / Junrui Li / Kai Wu / Tianyu Gao / Shengnan Zhu / Shi Lin / Ming-Wei Wang / Xi Cheng / Wanchao Yin / Yi Jiang / Dehua Yang / H Eric Xu /  要旨: Phosphorylation of G-protein-coupled receptors (GPCRs) by GPCR kinases (GRKs) desensitizes G-protein signalling and promotes arrestin signalling, which is also modulated by biased ligands. The ...Phosphorylation of G-protein-coupled receptors (GPCRs) by GPCR kinases (GRKs) desensitizes G-protein signalling and promotes arrestin signalling, which is also modulated by biased ligands. The molecular assembly of GRKs on GPCRs and the basis of GRK-mediated biased signalling remain largely unknown owing to the weak GPCR-GRK interactions. Here we report the complex structure of neurotensin receptor 1 (NTSR1) bound to GRK2, Gα and the arrestin-biased ligand SBI-553. The density map reveals the arrangement of the intact GRK2 with the receptor, with the N-terminal helix of GRK2 docking into the open cytoplasmic pocket formed by the outward movement of the receptor transmembrane helix 6, analogous to the binding of the G protein to the receptor. SBI-553 binds at the interface between GRK2 and NTSR1 to enhance GRK2 binding. The binding mode of SBI-553 is compatible with arrestin binding but clashes with the binding of Gα protein, thus providing a mechanism for its arrestin-biased signalling capability. In sum, our structure provides a rational model for understanding the details of GPCR-GRK interactions and GRK2-mediated biased signalling. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8jpe.cif.gz 8jpe.cif.gz | 69.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8jpe.ent.gz pdb8jpe.ent.gz | 45.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8jpe.json.gz 8jpe.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8jpe_validation.pdf.gz 8jpe_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8jpe_full_validation.pdf.gz 8jpe_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  8jpe_validation.xml.gz 8jpe_validation.xml.gz | 23.5 KB | 表示 | |
| CIF形式データ |  8jpe_validation.cif.gz 8jpe_validation.cif.gz | 31.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/jp/8jpe https://data.pdbj.org/pub/pdb/validation_reports/jp/8jpe ftp://data.pdbj.org/pub/pdb/validation_reports/jp/8jpe ftp://data.pdbj.org/pub/pdb/validation_reports/jp/8jpe | HTTPS FTP |
-関連構造データ
| 関連構造データ |  36477MC  8jpbC  8jpcC  8jpdC  8jpfC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 41282.895 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNAQ, GAQ Homo sapiens (ヒト) / 遺伝子: GNAQ, GAQ発現宿主:  参照: UniProt: P50148 |
|---|---|
| #2: 化合物 | ChemComp-GDP / |
| #3: 化合物 | ChemComp-MG / |
| #4: 化合物 | ChemComp-ALF / |
| 研究の焦点であるリガンドがあるか | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Focused refinement structure of Galpha(q) in NTSR1-GRK2-Galpha(q) complexes タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.4 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: DARK FIELD / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 1200 nm |
| 撮影 | 電子線照射量: 50 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3次元再構成 | 解像度: 2.91 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 474232 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー







 PDBj
PDBj