+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7t9i | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Native human TSH bound to human Thyrotropin receptor in complex with miniGs399 (composite structure) | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | MEMBRANE PROTEIN / G protein-coupled receptor / Thyroid-stimulating hormone receptor / Thyrotropin receptor / TSH / Thyroid | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報thyroid-stimulating hormone receptor activity / follicle-stimulating hormone activity / follicle-stimulating hormone complex / pituitary gonadotropin complex / luteinizing hormone secretion / follicle-stimulating hormone secretion / positive regulation of steroid biosynthetic process / Thyroxine biosynthesis / Mineralocorticoid biosynthesis / Hormone ligand-binding receptors ...thyroid-stimulating hormone receptor activity / follicle-stimulating hormone activity / follicle-stimulating hormone complex / pituitary gonadotropin complex / luteinizing hormone secretion / follicle-stimulating hormone secretion / positive regulation of steroid biosynthetic process / Thyroxine biosynthesis / Mineralocorticoid biosynthesis / Hormone ligand-binding receptors / Glycoprotein hormones / Reactions specific to the complex N-glycan synthesis pathway / Androgen biosynthesis / follicle-stimulating hormone signaling pathway / cochlea morphogenesis / inner ear receptor cell stereocilium organization / negative regulation of organ growth / thyroid hormone generation / positive regulation of multicellular organism growth / dopaminergic neuron differentiation / G protein-coupled peptide receptor activity / response to vitamin A / regulation of signaling receptor activity / regulation of locomotion / organ growth / PKA activation in glucagon signalling / thyroid gland development / hair follicle placode formation / lateral plasma membrane / mu-type opioid receptor binding / developmental growth / corticotropin-releasing hormone receptor 1 binding / intracellular transport / D1 dopamine receptor binding / anatomical structure morphogenesis / Hedgehog 'off' state / beta-2 adrenergic receptor binding / adenylate cyclase-activating adrenergic receptor signaling pathway / activation of adenylate cyclase activity / adenylate cyclase activator activity / TFAP2 (AP-2) family regulates transcription of growth factors and their receptors / hormone-mediated signaling pathway / adult locomotory behavior / B cell differentiation / trans-Golgi network membrane / insulin-like growth factor receptor binding / ionotropic glutamate receptor binding / G-protein beta/gamma-subunit complex binding / bone development / Olfactory Signaling Pathway / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / adenylate cyclase-activating G protein-coupled receptor signaling pathway / G-protein activation / hormone activity / G protein-coupled acetylcholine receptor signaling pathway / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / Glucagon signaling in metabolic regulation / G beta:gamma signalling through CDC42 / cognition / ADP signalling through P2Y purinoceptor 12 / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / Sensory perception of sweet, bitter, and umami (glutamate) taste / photoreceptor disc membrane / platelet aggregation / Adrenaline,noradrenaline inhibits insulin secretion / Glucagon-type ligand receptors / Vasopressin regulates renal water homeostasis via Aquaporins / response to calcium ion / Golgi lumen / G alpha (z) signalling events / cellular response to catecholamine stimulus / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / ADORA2B mediated anti-inflammatory cytokines production / response to estrogen / sensory perception of taste / ADP signalling through P2Y purinoceptor 1 / adenylate cyclase-activating dopamine receptor signaling pathway / G beta:gamma signalling through PI3Kgamma / cellular response to prostaglandin E stimulus / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / GPER1 signaling / G-protein beta-subunit binding / Inactivation, recovery and regulation of the phototransduction cascade / heterotrimeric G-protein complex / G alpha (12/13) signalling events / extracellular vesicle / sensory perception of smell / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / GTPase binding / cell-cell signaling / retina development in camera-type eye / phospholipase C-activating G protein-coupled receptor signaling pathway / Ca2+ pathway 類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | |||||||||
 データ登録者 データ登録者 | Faust, B. / Cheng, Y. / Manglik, A. | |||||||||
| 資金援助 | 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: Autoantibody mimicry of hormone action at the thyrotropin receptor. 著者: Bryan Faust / Christian B Billesbølle / Carl-Mikael Suomivuori / Isha Singh / Kaihua Zhang / Nicholas Hoppe / Antonio F M Pinto / Jolene K Diedrich / Yagmur Muftuoglu / Mariusz W Szkudlinski ...著者: Bryan Faust / Christian B Billesbølle / Carl-Mikael Suomivuori / Isha Singh / Kaihua Zhang / Nicholas Hoppe / Antonio F M Pinto / Jolene K Diedrich / Yagmur Muftuoglu / Mariusz W Szkudlinski / Alan Saghatelian / Ron O Dror / Yifan Cheng / Aashish Manglik /  要旨: Thyroid hormones are vital in metabolism, growth and development. Thyroid hormone synthesis is controlled by thyrotropin (TSH), which acts at the thyrotropin receptor (TSHR). In patients with Graves' ...Thyroid hormones are vital in metabolism, growth and development. Thyroid hormone synthesis is controlled by thyrotropin (TSH), which acts at the thyrotropin receptor (TSHR). In patients with Graves' disease, autoantibodies that activate the TSHR pathologically increase thyroid hormone activity. How autoantibodies mimic thyrotropin function remains unclear. Here we determined cryo-electron microscopy structures of active and inactive TSHR. In inactive TSHR, the extracellular domain lies close to the membrane bilayer. Thyrotropin selects an upright orientation of the extracellular domain owing to steric clashes between a conserved hormone glycan and the membrane bilayer. An activating autoantibody from a patient with Graves' disease selects a similar upright orientation of the extracellular domain. Reorientation of the extracellular domain transduces a conformational change in the seven-transmembrane-segment domain via a conserved hinge domain, a tethered peptide agonist and a phospholipid that binds within the seven-transmembrane-segment domain. Rotation of the TSHR extracellular domain relative to the membrane bilayer is sufficient for receptor activation, revealing a shared mechanism for other glycoprotein hormone receptors that may also extend to other G-protein-coupled receptors with large extracellular domains. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7t9i.cif.gz 7t9i.cif.gz | 502.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7t9i.ent.gz pdb7t9i.ent.gz | 412.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7t9i.json.gz 7t9i.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7t9i_validation.pdf.gz 7t9i_validation.pdf.gz | 923.5 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7t9i_full_validation.pdf.gz 7t9i_full_validation.pdf.gz | 927.4 KB | 表示 | |
| XML形式データ |  7t9i_validation.xml.gz 7t9i_validation.xml.gz | 46.7 KB | 表示 | |
| CIF形式データ |  7t9i_validation.cif.gz 7t9i_validation.cif.gz | 69.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/t9/7t9i https://data.pdbj.org/pub/pdb/validation_reports/t9/7t9i ftp://data.pdbj.org/pub/pdb/validation_reports/t9/7t9i ftp://data.pdbj.org/pub/pdb/validation_reports/t9/7t9i | HTTPS FTP |
-関連構造データ
| 関連構造データ |  25758MC  7t9mC  7t9nC  7utzC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 電子顕微鏡画像生データ |  EMPIAR-11120 (タイトル: Single-particle cryo-electron microscopy final particle stacks and .star files from TSHR complexes EMPIAR-11120 (タイトル: Single-particle cryo-electron microscopy final particle stacks and .star files from TSHR complexesData size: 828.7 Data #1: Final particle stack for CS-17 Fab-bound TSHR Gs reconstruction [picked particles - single frame - processed] Data #2: Final particle stack for M22 Fab-bound TSHR-Gs reconstruction [picked particles - single frame - processed] Data #3: Final particle stack for TR1402-bound TSHR-Gs reconstruction [picked particles - single frame - processed] Data #4: Final particle stack for native human TSH-bound TSHR-Gs reconstruction [picked particles - single frame - processed]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 3種, 3分子 ABR
| #1: タンパク質 | 分子量: 10217.769 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P01215 Homo sapiens (ヒト) / 参照: UniProt: P01215 |
|---|---|
| #2: タンパク質 | 分子量: 12915.974 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P01222 Homo sapiens (ヒト) / 参照: UniProt: P01222 |
| #4: タンパク質 | 分子量: 79742.375 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: TSHR / 発現宿主: Homo sapiens (ヒト) / 遺伝子: TSHR / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: A0A0A0MTJ0 Homo sapiens (ヒト) / 参照: UniProt: A0A0A0MTJ0 |
-Guanine nucleotide-binding protein ... , 3種, 3分子 XYZ
| #5: タンパク質 | 分子量: 30137.025 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNAS, GNAS1, GSP / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GNAS, GNAS1, GSP / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P63092 Homo sapiens (ヒト) / 参照: UniProt: P63092 |
|---|---|
| #6: タンパク質 | 分子量: 40786.566 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNB1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GNB1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P62873 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P62873 |
| #7: タンパク質 | 分子量: 7861.143 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNG2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GNG2 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P59768 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P59768 |
-抗体 , 1種, 1分子 N
| #3: 抗体 | 分子量: 15398.067 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   |
|---|
-糖 , 2種, 7分子 
| #8: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
|---|---|
| #9: 糖 | ChemComp-NAG / |
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Native human TSH bound to human Thyrotropin receptor in complex with miniGs399 (composite structure) タイプ: COMPLEX / Entity ID: #1-#7 / 由来: MULTIPLE SOURCES |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) / 株: expi293 Homo sapiens (ヒト) / 株: expi293 |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277.15 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: TFS KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 130000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 800 nm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 77 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.19.1_4122: / 分類: 精密化 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 6185950 | ||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 80483 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT | ||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー






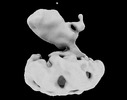


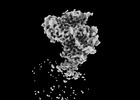

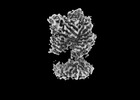

 PDBj
PDBj




























