+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7mts | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | CryoEM Structure of mGlu2 - Gi Complex | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | MEMBRANE PROTEIN/SIGNALING PROTEIN / Metabotropic Glutamate Receptor 2 (mGlu2) (mGluR2) / Family C G protein-coupled receptor (GPCR) / Heterotrimeric G protein / CryoEM structure / MEMBRANE PROTEIN / MEMBRANE PROTEIN-SIGNALING PROTEIN complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of response to drug / group II metabotropic glutamate receptor activity / intracellular glutamate homeostasis / behavioral response to nicotine / negative regulation of adenylate cyclase activity / G protein-coupled glutamate receptor signaling pathway / astrocyte projection / Class C/3 (Metabotropic glutamate/pheromone receptors) / glutamate receptor activity / glutamate secretion ...regulation of response to drug / group II metabotropic glutamate receptor activity / intracellular glutamate homeostasis / behavioral response to nicotine / negative regulation of adenylate cyclase activity / G protein-coupled glutamate receptor signaling pathway / astrocyte projection / Class C/3 (Metabotropic glutamate/pheromone receptors) / glutamate receptor activity / glutamate secretion / long-term synaptic depression / regulation of glutamate secretion / cellular response to stress / regulation of dopamine secretion / adenylate cyclase inhibitor activity / positive regulation of protein localization to cell cortex / T cell migration / Adenylate cyclase inhibitory pathway / regulation of synaptic transmission, glutamatergic / D2 dopamine receptor binding / response to prostaglandin E / G protein-coupled serotonin receptor binding / adenylate cyclase regulator activity / adenylate cyclase-inhibiting serotonin receptor signaling pathway / presynaptic modulation of chemical synaptic transmission / cellular response to forskolin / calcium channel regulator activity / regulation of mitotic spindle organization / Regulation of insulin secretion / response to cocaine / positive regulation of cholesterol biosynthetic process / G protein-coupled receptor binding / negative regulation of insulin secretion / G protein-coupled receptor activity / adenylate cyclase-inhibiting G protein-coupled receptor signaling pathway / response to peptide hormone / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / G-protein beta/gamma-subunit complex binding / centriolar satellite / Olfactory Signaling Pathway / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / G protein-coupled acetylcholine receptor signaling pathway / G-protein activation / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / G beta:gamma signalling through CDC42 / Glucagon signaling in metabolic regulation / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / ADP signalling through P2Y purinoceptor 12 / Sensory perception of sweet, bitter, and umami (glutamate) taste / photoreceptor disc membrane / Glucagon-type ligand receptors / Adrenaline,noradrenaline inhibits insulin secretion / Vasopressin regulates renal water homeostasis via Aquaporins / GDP binding / G alpha (z) signalling events / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / cellular response to catecholamine stimulus / ADP signalling through P2Y purinoceptor 1 / ADORA2B mediated anti-inflammatory cytokines production / G beta:gamma signalling through PI3Kgamma / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / adenylate cyclase-activating dopamine receptor signaling pathway / GPER1 signaling / Inactivation, recovery and regulation of the phototransduction cascade / cellular response to prostaglandin E stimulus / G-protein beta-subunit binding / heterotrimeric G-protein complex / G alpha (12/13) signalling events / sensory perception of taste / extracellular vesicle / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / retina development in camera-type eye / G protein activity / presynaptic membrane / GTPase binding / Ca2+ pathway / midbody / fibroblast proliferation / scaffold protein binding / cell cortex / High laminar flow shear stress activates signaling by PIEZO1 and PECAM1:CDH5:KDR in endothelial cells / G alpha (i) signalling events / G alpha (s) signalling events / phospholipase C-activating G protein-coupled receptor signaling pathway / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / chemical synaptic transmission / G alpha (q) signalling events / gene expression / Ras protein signal transduction / postsynaptic membrane / Extra-nuclear estrogen signaling / cell population proliferation / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | ||||||
 データ登録者 データ登録者 | Seven, A.B. / Barros-Alvarez, X. / Skiniotis, G. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2021 ジャーナル: Nature / 年: 2021タイトル: G-protein activation by a metabotropic glutamate receptor. 著者: Alpay B Seven / Ximena Barros-Álvarez / Marine de Lapeyrière / Makaía M Papasergi-Scott / Michael J Robertson / Chensong Zhang / Robert M Nwokonko / Yang Gao / Justin G Meyerowitz / Jean- ...著者: Alpay B Seven / Ximena Barros-Álvarez / Marine de Lapeyrière / Makaía M Papasergi-Scott / Michael J Robertson / Chensong Zhang / Robert M Nwokonko / Yang Gao / Justin G Meyerowitz / Jean-Philippe Rocher / Dominik Schelshorn / Brian K Kobilka / Jesper M Mathiesen / Georgios Skiniotis /    要旨: Family C G-protein-coupled receptors (GPCRs) operate as obligate dimers with extracellular domains that recognize small ligands, leading to G-protein activation on the transmembrane (TM) domains of ...Family C G-protein-coupled receptors (GPCRs) operate as obligate dimers with extracellular domains that recognize small ligands, leading to G-protein activation on the transmembrane (TM) domains of these receptors by an unknown mechanism. Here we show structures of homodimers of the family C metabotropic glutamate receptor 2 (mGlu2) in distinct functional states and in complex with heterotrimeric G. Upon activation of the extracellular domain, the two transmembrane domains undergo extensive rearrangement in relative orientation to establish an asymmetric TM6-TM6 interface that promotes conformational changes in the cytoplasmic domain of one protomer. Nucleotide-bound G can be observed pre-coupled to inactive mGlu2, but its transition to the nucleotide-free form seems to depend on establishing the active-state TM6-TM6 interface. In contrast to family A and B GPCRs, G-protein coupling does not involve the cytoplasmic opening of TM6 but is facilitated through the coordination of intracellular loops 2 and 3, as well as a critical contribution from the C terminus of the receptor. The findings highlight the synergy of global and local conformational transitions to facilitate a new mode of G-protein activation. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7mts.cif.gz 7mts.cif.gz | 417.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7mts.ent.gz pdb7mts.ent.gz | 325.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7mts.json.gz 7mts.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7mts_validation.pdf.gz 7mts_validation.pdf.gz | 794 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7mts_full_validation.pdf.gz 7mts_full_validation.pdf.gz | 807.1 KB | 表示 | |
| XML形式データ |  7mts_validation.xml.gz 7mts_validation.xml.gz | 58.2 KB | 表示 | |
| CIF形式データ |  7mts_validation.cif.gz 7mts_validation.cif.gz | 89.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/mt/7mts https://data.pdbj.org/pub/pdb/validation_reports/mt/7mts ftp://data.pdbj.org/pub/pdb/validation_reports/mt/7mts ftp://data.pdbj.org/pub/pdb/validation_reports/mt/7mts | HTTPS FTP |
-関連構造データ
| 関連構造データ |  23996MC  7mtqC  7mtrC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10979 (タイトル: CryoEM Structure of mGlu2 - Gi Complex / Data size: 21.6 TB EMPIAR-10979 (タイトル: CryoEM Structure of mGlu2 - Gi Complex / Data size: 21.6 TBData #1: Unaligned multi-frame micrographs of mGlu2 - Gi Complex [micrographs - multiframe]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Guanine nucleotide-binding protein ... , 3種, 3分子 CDE
| #2: タンパク質 | 分子量: 40415.031 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNAI1 Homo sapiens (ヒト) / 遺伝子: GNAI1発現宿主:  参照: UniProt: P63096 |
|---|---|
| #3: タンパク質 | 分子量: 37342.785 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNB1 Homo sapiens (ヒト) / 遺伝子: GNB1発現宿主:  参照: UniProt: P62873 |
| #4: タンパク質 | 分子量: 7861.143 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNG2 Homo sapiens (ヒト) / 遺伝子: GNG2発現宿主:  参照: UniProt: P59768 |
-タンパク質 / 糖 , 2種, 4分子 AB

| #1: タンパク質 | 分子量: 93932.445 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GRM2, GPRC1B, MGLUR2 Homo sapiens (ヒト) / 遺伝子: GRM2, GPRC1B, MGLUR2発現宿主:  参照: UniProt: Q14416 #7: 糖 | |
|---|
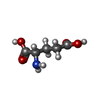
-非ポリマー , 2種, 3分子 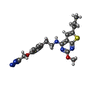

| #5: 化合物 | ChemComp-ZQY / |
|---|---|
| #6: 化合物 |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: mGlu2 - Heterotrimeric Gi complex / タイプ: COMPLEX 詳細: Heterotrimeric G protein coupled metabotropic glutamate receptor 2 bound to Ago-PAM ADX55164 and L-Glutamate Entity ID: #1-#4 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 0.277 MDa / 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドのタイプ: Quantifoil R1.2/1.3 |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 1000 nm / Cs: 2.7 mm / C2レンズ絞り径: 50 µm |
| 撮影 | 電子線照射量: 1.3 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 799323 / 詳細: A composite map of four locally refined maps. / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj






























