+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6sj7 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Structure of the human DDB1-DDA1-DCAF15 E3 ubiquitin ligase bound to RBM39 and Indisulam | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | ONCOPROTEIN / DDB1 | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報RS domain binding / regulation of natural killer cell activation / positive regulation by virus of viral protein levels in host cell / epigenetic programming in the zygotic pronuclei / spindle assembly involved in female meiosis / U1 snRNP binding / Cul4-RING E3 ubiquitin ligase complex / UV-damage excision repair / regulation of mRNA splicing, via spliceosome / biological process involved in interaction with symbiont ...RS domain binding / regulation of natural killer cell activation / positive regulation by virus of viral protein levels in host cell / epigenetic programming in the zygotic pronuclei / spindle assembly involved in female meiosis / U1 snRNP binding / Cul4-RING E3 ubiquitin ligase complex / UV-damage excision repair / regulation of mRNA splicing, via spliceosome / biological process involved in interaction with symbiont / regulation of mitotic cell cycle phase transition / Cul4A-RING E3 ubiquitin ligase complex / WD40-repeat domain binding / ubiquitin ligase complex scaffold activity / Cul4B-RING E3 ubiquitin ligase complex / immune system process / negative regulation of reproductive process / negative regulation of developmental process / small molecule binding / cullin family protein binding / centriolar satellite / viral release from host cell / ectopic germ cell programmed cell death / proteasomal protein catabolic process / positive regulation of viral genome replication / RNA processing / positive regulation of gluconeogenesis / mRNA Splicing - Major Pathway / RNA splicing / nucleotide-excision repair / Recognition of DNA damage by PCNA-containing replication complex / DNA Damage Recognition in GG-NER / regulation of circadian rhythm / Transcription-Coupled Nucleotide Excision Repair (TC-NER) / Formation of TC-NER Pre-Incision Complex / Dual Incision in GG-NER / Wnt signaling pathway / Formation of Incision Complex in GG-NER / Dual incision in TC-NER / Gap-filling DNA repair synthesis and ligation in TC-NER / mRNA processing / protein polyubiquitination / positive regulation of protein catabolic process / microtubule cytoskeleton / cellular response to UV / positive regulation of proteasomal ubiquitin-dependent protein catabolic process / rhythmic process / Neddylation / protein-macromolecule adaptor activity / site of double-strand break / ubiquitin-dependent protein catabolic process / proteasome-mediated ubiquitin-dependent protein catabolic process / damaged DNA binding / chromosome, telomeric region / protein ubiquitination / nuclear speck / DNA repair / DNA damage response / protein-containing complex binding / nucleolus / negative regulation of apoptotic process / apoptotic process / protein-containing complex / DNA binding / RNA binding / extracellular space / extracellular exosome / nucleoplasm / nucleus / metal ion binding / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.54 Å | ||||||
 データ登録者 データ登録者 | Srinivas, H. | ||||||
 引用 引用 |  ジャーナル: Nat Chem Biol / 年: 2020 ジャーナル: Nat Chem Biol / 年: 2020タイトル: Structural basis of indisulam-mediated RBM39 recruitment to DCAF15 E3 ligase complex. 著者: Dirksen E Bussiere / Lili Xie / Honnappa Srinivas / Wei Shu / Ashley Burke / Celine Be / Junping Zhao / Adarsh Godbole / Dan King / Rajeshri G Karki / Viktor Hornak / Fangmin Xu / Jennifer ...著者: Dirksen E Bussiere / Lili Xie / Honnappa Srinivas / Wei Shu / Ashley Burke / Celine Be / Junping Zhao / Adarsh Godbole / Dan King / Rajeshri G Karki / Viktor Hornak / Fangmin Xu / Jennifer Cobb / Nathalie Carte / Andreas O Frank / Alexandra Frommlet / Patrick Graff / Mark Knapp / Aleem Fazal / Barun Okram / Songchun Jiang / Pierre-Yves Michellys / Rohan Beckwith / Hans Voshol / Christian Wiesmann / Jonathan M Solomon / Joshiawa Paulk /   要旨: The anticancer agent indisulam inhibits cell proliferation by causing degradation of RBM39, an essential mRNA splicing factor. Indisulam promotes an interaction between RBM39 and the DCAF15 E3 ligase ...The anticancer agent indisulam inhibits cell proliferation by causing degradation of RBM39, an essential mRNA splicing factor. Indisulam promotes an interaction between RBM39 and the DCAF15 E3 ligase substrate receptor, leading to RBM39 ubiquitination and proteasome-mediated degradation. To delineate the precise mechanism by which indisulam mediates the DCAF15-RBM39 interaction, we solved the DCAF15-DDB1-DDA1-indisulam-RBM39(RRM2) complex structure to a resolution of 2.3 Å. DCAF15 has a distinct topology that embraces the RBM39(RRM2) domain largely via non-polar interactions, and indisulam binds between DCAF15 and RBM39(RRM2), coordinating additional interactions between the two proteins. Studies with RBM39 point mutants and indisulam analogs validated the structural model and defined the RBM39 α-helical degron motif. The degron is found only in RBM23 and RBM39, and only these proteins were detectably downregulated in indisulam-treated HCT116 cells. This work further explains how indisulam induces RBM39 degradation and defines the challenge of harnessing DCAF15 to degrade additional targets. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6sj7.cif.gz 6sj7.cif.gz | 247.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6sj7.ent.gz pdb6sj7.ent.gz | 193.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6sj7.json.gz 6sj7.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/sj/6sj7 https://data.pdbj.org/pub/pdb/validation_reports/sj/6sj7 ftp://data.pdbj.org/pub/pdb/validation_reports/sj/6sj7 ftp://data.pdbj.org/pub/pdb/validation_reports/sj/6sj7 | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 66563.297 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: DCAF15, C19orf72 / 細胞株 (発現宿主): Sf21 Homo sapiens (ヒト) / 遺伝子: DCAF15, C19orf72 / 細胞株 (発現宿主): Sf21発現宿主:  参照: UniProt: Q66K64 |
|---|---|
| #2: タンパク質 | 分子量: 127097.469 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: DDB1, XAP1 / 細胞株 (発現宿主): Sf21 Homo sapiens (ヒト) / 遺伝子: DDB1, XAP1 / 細胞株 (発現宿主): Sf21発現宿主:  参照: UniProt: Q16531 |
| #3: タンパク質 | 分子量: 9085.409 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: DKFZp781I1140 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: DKFZp781I1140 / 発現宿主:  |
| #4: タンパク質 | 分子量: 11724.102 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: DDA1, C19orf58, PCIA1 / 細胞株 (発現宿主): Sf21 Homo sapiens (ヒト) / 遺伝子: DDA1, C19orf58, PCIA1 / 細胞株 (発現宿主): Sf21発現宿主:  参照: UniProt: Q9BW61 |
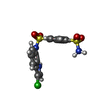
| #5: 化合物 | ChemComp-EF6 / |
| 研究の焦点であるリガンドがあるか | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.21 MDa / 実験値: YES | ||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 撮影 | 電子線照射量: 40 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) |
- 解析
解析
| CTF補正 | タイプ: NONE |
|---|---|
| 3次元再構成 | 解像度: 3.54 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 380000 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj