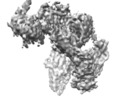
登録情報 データベース : EMDB / ID : EMD-9838タイトル Cryo-EM structure of the full-length human IGF-1R in complex with insulin 複合体 : complex of full-length human type 1 insulin-like growth factor receptor with insulinタンパク質・ペプチド : Insulin-like growth factor 1 receptorリガンド : 2-acetamido-2-deoxy-beta-D-glucopyranose機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 5.0 Å Zhang X / Yu D / Wang T 資金援助 Organization Grant number 国 Ministry of Science and Technology (China) 2018YFA0507103 National Natural Science Foundation of China 11774011 National Natural Science Foundation of China 31870719
ジャーナル : Structure / 年 : 2020タイトル : Visualization of Ligand-Bound Ectodomain Assembly in the Full-Length Human IGF-1 Receptor by Cryo-EM Single-Particle Analysis.著者: Xi Zhang / Daqi Yu / Jingchuan Sun / Yujie Wu / Junyuan Gong / Xuemei Li / Li Liu / Shan Liu / Jianbo Liu / Yulan Wu / Dongyang Li / Yinping Ma / Xu Han / Yanan Zhu / Zhaolong Wu / Yihua Wang ... 著者 : Xi Zhang / Daqi Yu / Jingchuan Sun / Yujie Wu / Junyuan Gong / Xuemei Li / Li Liu / Shan Liu / Jianbo Liu / Yulan Wu / Dongyang Li / Yinping Ma / Xu Han / Yanan Zhu / Zhaolong Wu / Yihua Wang / Qi Ouyang / Tao Wang / 要旨 : Tyrosine kinase receptor of insulin-like growth factor 1 receptor (IGF-1R) and insulin receptor (IR) bind to hormones, such as insulin, IGF-1, and IGF-2, and transduces the signals across the cell ... Tyrosine kinase receptor of insulin-like growth factor 1 receptor (IGF-1R) and insulin receptor (IR) bind to hormones, such as insulin, IGF-1, and IGF-2, and transduces the signals across the cell membrane. However, the complete structure of the receptor and the signal transduction mechanism remains unclear. Here, we report the cryo-EM structure of the ligand-bound ectodomain in the full-length human IGF-1R. We reconstructed the IGF-1R/insulin complex at 4.7 Å and the IGF-1R/IGF-1 complex at 7.7 Å. Our structures reveal that only one insulin or one IGF-1 molecule binds to and activates the full-length human IGF-1R receptor. 履歴 登録 2019年2月27日 - ヘッダ(付随情報) 公開 2020年1月1日 - マップ公開 2020年3月4日 - 更新 2020年7月29日 - 現状 2020年7月29日 処理サイト : PDBj / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 中国, 3件
中国, 3件  引用
引用 ジャーナル: Structure / 年: 2020
ジャーナル: Structure / 年: 2020
 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_9838.map.gz
emd_9838.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-9838-v30.xml
emd-9838-v30.xml emd-9838.xml
emd-9838.xml EMDBヘッダ
EMDBヘッダ emd_9838_fsc.xml
emd_9838_fsc.xml FSCデータファイル
FSCデータファイル emd_9838.png
emd_9838.png http://ftp.pdbj.org/pub/emdb/structures/EMD-9838
http://ftp.pdbj.org/pub/emdb/structures/EMD-9838 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9838
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9838 emd_9838_validation.pdf.gz
emd_9838_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_9838_full_validation.pdf.gz
emd_9838_full_validation.pdf.gz emd_9838_validation.xml.gz
emd_9838_validation.xml.gz emd_9838_validation.cif.gz
emd_9838_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9838
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9838 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9838
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9838 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_9838.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_9838.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト) / 組換細胞: HEK293T
Homo sapiens (ヒト) / 組換細胞: HEK293T Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー