+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9272 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | EM structure of Bacillus subtilis ribonucleotide reductase inhibited filament composed of NrdE alpha subunit and NrdF beta subunit with dATP | |||||||||
 マップデータ マップデータ | ASU of Bacillus subtilis ribonucleotide reductase inhibited filament composed of NrdE alpha and NrdF beta subunits with dATP. Handedness already corrected by reference to NrdE crystal structures. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ribonucleotide reductase / allostery / nucleotide metabolism / filament / dATP / ATP / OXIDOREDUCTASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ribonucleoside-diphosphate reductase complex / ribonucleoside-diphosphate reductase / ribonucleoside-diphosphate reductase activity, thioredoxin disulfide as acceptor / deoxyribonucleotide biosynthetic process / DNA replication / ATP binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
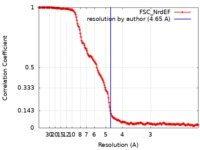
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 4.65 Å | |||||||||
 データ登録者 データ登録者 | Thomas WC / Bacik JP / Kaelber JT / Ando N | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2019 ジャーナル: Nat Commun / 年: 2019タイトル: Convergent allostery in ribonucleotide reductase. 著者: William C Thomas / F Phil Brooks / Audrey A Burnim / John-Paul Bacik / JoAnne Stubbe / Jason T Kaelber / James Z Chen / Nozomi Ando /  要旨: Ribonucleotide reductases (RNRs) use a conserved radical-based mechanism to catalyze the conversion of ribonucleotides to deoxyribonucleotides. Within the RNR family, class Ib RNRs are notable for ...Ribonucleotide reductases (RNRs) use a conserved radical-based mechanism to catalyze the conversion of ribonucleotides to deoxyribonucleotides. Within the RNR family, class Ib RNRs are notable for being largely restricted to bacteria, including many pathogens, and for lacking an evolutionarily mobile ATP-cone domain that allosterically controls overall activity. In this study, we report the emergence of a distinct and unexpected mechanism of activity regulation in the sole RNR of the model organism Bacillus subtilis. Using a hypothesis-driven structural approach that combines the strengths of small-angle X-ray scattering (SAXS), crystallography, and cryo-electron microscopy (cryo-EM), we describe the reversible interconversion of six unique structures, including a flexible active tetramer and two inhibited helical filaments. These structures reveal the conformational gymnastics necessary for RNR activity and the molecular basis for its control via an evolutionarily convergent form of allostery. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9272.map.gz emd_9272.map.gz | 9.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9272-v30.xml emd-9272-v30.xml emd-9272.xml emd-9272.xml | 21.2 KB 21.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_9272_fsc.xml emd_9272_fsc.xml | 16.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_9272.png emd_9272.png | 31.9 KB | ||
| マスクデータ |  emd_9272_msk_1.map emd_9272_msk_1.map | 421.9 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-9272.cif.gz emd-9272.cif.gz | 7.5 KB | ||
| その他 |  emd_9272_half_map_1.map.gz emd_9272_half_map_1.map.gz emd_9272_half_map_2.map.gz emd_9272_half_map_2.map.gz | 391.2 MB 391.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9272 http://ftp.pdbj.org/pub/emdb/structures/EMD-9272 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9272 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9272 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_9272_validation.pdf.gz emd_9272_validation.pdf.gz | 1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_9272_full_validation.pdf.gz emd_9272_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  emd_9272_validation.xml.gz emd_9272_validation.xml.gz | 22.9 KB | 表示 | |
| CIF形式データ |  emd_9272_validation.cif.gz emd_9272_validation.cif.gz | 29.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9272 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9272 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9272 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9272 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9272.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9272.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | ASU of Bacillus subtilis ribonucleotide reductase inhibited filament composed of NrdE alpha and NrdF beta subunits with dATP. Handedness already corrected by reference to NrdE crystal structures. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_9272_msk_1.map emd_9272_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Unfiltered, unmasked, half-map from refinement of NrdEF
| ファイル | emd_9272_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unfiltered, unmasked, half-map from refinement of NrdEF | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Unfiltered, unmasked half-map from refinement of NrdEF
| ファイル | emd_9272_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unfiltered, unmasked half-map from refinement of NrdEF | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Inhibited filament of ribonucleoside-diphosphate reductase compos...
| 全体 | 名称: Inhibited filament of ribonucleoside-diphosphate reductase composed of NrdE alpha subunits and NrdF beta subunit tails |
|---|---|
| 要素 |
|
-超分子 #1: Inhibited filament of ribonucleoside-diphosphate reductase compos...
| 超分子 | 名称: Inhibited filament of ribonucleoside-diphosphate reductase composed of NrdE alpha subunits and NrdF beta subunit tails タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 詳細: Beta subunit core density only visible at low threshold. Beta subunit tail is bound with strong density to alpha subunit and modeled as a poly-A peptide in the model. |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Ribonucleoside-diphosphate reductase
| 分子 | 名称: Ribonucleoside-diphosphate reductase / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号: ribonucleoside-diphosphate reductase |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 80.791469 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSQNQVPKWI QLNNEIMIQK DGKFQFDKDK EAVHSYFVDY INQNTVFFHN LKEKLDYLVE NQYYEEEFLS LYSFEDIKEV FKTAYAKKF RFPSFMSAFK FYNDYALKTN DKKKILERYE DRISIVALFF ANGDTEKAKE YVNLMINQEY QPSTPTFLNA G RKRRGELV ...文字列: MSQNQVPKWI QLNNEIMIQK DGKFQFDKDK EAVHSYFVDY INQNTVFFHN LKEKLDYLVE NQYYEEEFLS LYSFEDIKEV FKTAYAKKF RFPSFMSAFK FYNDYALKTN DKKKILERYE DRISIVALFF ANGDTEKAKE YVNLMINQEY QPSTPTFLNA G RKRRGELV SCFLLEVNDS LNDISRAIDI SMQLSKLGGG VSLNLSKLRA KGEAIKDVEN ATKGVVGVMK LLDNAFRYAD QM GQRQGSG AAYLNIFHRD INDFLDTKKI SADEDVRVKT LSIGVVIPDK FVELAREDKA AYVFYPHTIY KEYGQHMDEM DMN EMYDKF VDNPRVKKEK INPRKLLEKL AMLRSESGYP YIMFQDNVNK VHANNHISKV KFSNLCSEVL QASQVSSYTD YDEE DEIGL DISCNLGSLN ILNVMEHKSI EKTVKLATDS LTHVSETTDI RNAPAVRRAN KAMKSIGLGA MNLHGYLAQN GIAYE SPEA RDFANTFFMM VNFYSIQRSA EIAKEKGETF DQYEGSTYAT GEYFDKYVST DFSPKYEKIA NLFEGMHIPT TEDWKK LKA FVAEHGMYHS YRLCIAPTGS ISYVQSSTAS VMPIMERIEE RTYGNSKTYY PMPGLASNNW FFYKEAYDMD MFKVVDM IA TIQQHIDQGI SFTLFLKDTM TTRDLNRIDL YAHHRGIKTI YYARTKDTGQ DSCLSCVV UniProtKB: Ribonucleoside-diphosphate reductase |
-分子 #2: Ribonucleoside-diphosphate reductase NrdF beta subunit
| 分子 | 名称: Ribonucleoside-diphosphate reductase NrdF beta subunit タイプ: protein_or_peptide / ID: 2 / 詳細: C-terminus modeled as a polyalanine chain / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 698.854 Da |
| 組換発現 | 生物種:  |
| 配列 | 文字列: (UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK) |
-分子 #3: 2'-DEOXYADENOSINE 5'-TRIPHOSPHATE
| 分子 | 名称: 2'-DEOXYADENOSINE 5'-TRIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 4 / 式: DTP |
|---|---|
| 分子量 | 理論値: 491.182 Da |
| Chemical component information |  ChemComp-DTP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.40 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.6 構成要素:
詳細: Glycerol in original storage buffer was diluted to < 0.25% w/v. | |||||||||||||||
| グリッド | 詳細: unspecified | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / 装置: LEICA EM GP | |||||||||||||||
| 詳細 | Cryo-EM samples of the NrdEF filament were prepared by mixing 20 uM C382S holo-NrdE with 20 or 40 uM Mn-reconstituted NrdF in assay buffer with 100 uM dATP and 1 mM CDP, prior to dilution with nucleotide-containing buffer to a concentration of 5 uM protein. A subset of the grids were pre-coated with a support film of continuous, amorphous carbon by flotation of cleaved mica. For these grids, the sample was diluted to a final protein concentration of 2 uM. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / 実像数: 2843 / 平均電子線量: 8.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 精密化 | 空間: REAL / プロトコル: OTHER / 当てはまり具合の基準: Correlation coefficient |
| 得られたモデル |  PDB-6mw3: |
 ムービー
ムービー コントローラー
コントローラー
















 Z
Z Y
Y X
X