登録情報 データベース : EMDB / ID : EMD-6987タイトル Cryo-EM structure of a P-type ATPase 複合体 : complex of one PMCA1 molecular with one NPTN molecularタンパク質・ペプチド : Plasma membrane calcium-transporting ATPase 1タンパク質・ペプチド : Neuroplastinリガンド : N-ACETYL-D-GLUCOSAMINE機能・相同性 分子機能 ドメイン・相同性 構成要素
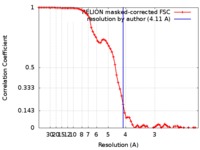
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト) / Human (ヒト)手法 / / 解像度 : 4.11 Å Gong DS / Chi XM / Ren K / Huang GXY / Zhou GW / Yan N / Lei JL / Zhou Q ジャーナル : Nat Commun / 年 : 2018タイトル : Structure of the human plasma membrane Ca-ATPase 1 in complex with its obligatory subunit neuroplastin.著者 : Deshun Gong / Ximin Chi / Kang Ren / Gaoxingyu Huang / Gewei Zhou / Nieng Yan / Jianlin Lei / Qiang Zhou / 要旨 : Plasma membrane Ca-ATPases (PMCAs) are key regulators of global Ca homeostasis and local intracellular Ca dynamics. Recently, Neuroplastin (NPTN) and basigin were identified as previously ... Plasma membrane Ca-ATPases (PMCAs) are key regulators of global Ca homeostasis and local intracellular Ca dynamics. Recently, Neuroplastin (NPTN) and basigin were identified as previously unrecognized obligatory subunits of PMCAs that dramatically increase the efficiency of PMCA-mediated Ca clearance. Here, we report the cryo-EM structure of human PMCA1 (hPMCA1) in complex with NPTN at a resolution of 4.1 Å for the overall structure and 3.9 Å for the transmembrane domain. The single transmembrane helix of NPTN interacts with the TM-linker and TM10 of hPMCA1. The subunits are required for the hPMCA1 functional activity. The NPTN-bound hPMCA1 closely resembles the E1-Mg structure of endo(sarco)plasmic reticulum Ca ATPase and the Ca site is exposed through a large open cytoplasmic pathway. This structure provides insight into how the subunits bind to the PMCAs and serves as an important basis for understanding the functional mechanisms of this essential calcium pump family. 履歴 登録 2018年6月27日 - ヘッダ(付随情報) 公開 2018年9月19日 - マップ公開 2018年9月19日 - 更新 2018年9月19日 - 現状 2018年9月19日 処理サイト : PDBj / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト) /
Homo sapiens (ヒト) /  Human (ヒト)
Human (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: Nat Commun / 年: 2018
ジャーナル: Nat Commun / 年: 2018

 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_6987.map.gz
emd_6987.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-6987-v30.xml
emd-6987-v30.xml emd-6987.xml
emd-6987.xml EMDBヘッダ
EMDBヘッダ emd_6987_fsc.xml
emd_6987_fsc.xml FSCデータファイル
FSCデータファイル emd_6987.png
emd_6987.png http://ftp.pdbj.org/pub/emdb/structures/EMD-6987
http://ftp.pdbj.org/pub/emdb/structures/EMD-6987 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6987
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6987 emd_6987_validation.pdf.gz
emd_6987_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_6987_full_validation.pdf.gz
emd_6987_full_validation.pdf.gz emd_6987_validation.xml.gz
emd_6987_validation.xml.gz emd_6987_validation.cif.gz
emd_6987_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6987
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6987 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6987
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6987 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_6987.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_6987.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Human (ヒト)
Human (ヒト) 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー




















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)