+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-25696 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
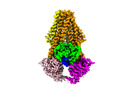
| タイトル | Cryo-EM structure of PCAT1 in the inward-facing intermediate conformation under ATP turnover condition | |||||||||
 マップデータ マップデータ | full map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ATP-binding cassette / ABC transporter / protein transport / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ABC-type bacteriocin transporter activity / ATPase-coupled lipid transmembrane transporter activity / cysteine-type peptidase activity / ATP hydrolysis activity / proteolysis / ATP binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Acetivibrio thermocellus (バクテリア) Acetivibrio thermocellus (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.7 Å | |||||||||
 データ登録者 データ登録者 | Kieuvongngam V / Chen J | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2022 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022タイトル: Structures of the peptidase-containing ABC transporter PCAT1 under equilibrium and nonequilibrium conditions. 著者: Virapat Kieuvongngam / Jue Chen /  要旨: ATP-binding cassette (ABC) transporters are ubiquitous molecular pumps that transport a broad range of substrates across biological membranes. Although the structure and function of ABC transporters ...ATP-binding cassette (ABC) transporters are ubiquitous molecular pumps that transport a broad range of substrates across biological membranes. Although the structure and function of ABC transporters has been studied extensively, our understanding of their energetics and dynamics remains limited. Here, we present studies of the peptidase-containing ABC transporter 1 (PCAT1), a polypeptide processing and secretion ABC transporter that functions via the classic alternating access mechanism. PCAT1 is a homodimer containing two peptidase (PEP) domains, two transmembrane domains, and two nucleotide-binding domains (NBDs). Using cryo-electron microscopy, we analyzed the structures of wild-type PCAT1 under conditions that either prevent or permit ATP hydrolysis and observed two completely different conformational distributions. In the presence of ATP but absence of Mg, PCAT1 adopts an NBD-dimerized, outward-facing conformation. The two PEP domains are dissociated from the transporter core, preventing uncoupled substrate cleavage. The addition of Mg to promote ATP hydrolysis shifts the majority of the particles into NBD-separated, inward-facing conformations. Under this ATP turnover condition, only a small fraction of PCAT1 adopts the NBD-dimerized conformation. These data give rise to two mechanistic conclusions: 1) the ATP-bound, NBD-dimerized conformation is the lowest energy state, and 2) the rate-limiting step in the PCAT1 transport cycle is the formation of the NBD dimer. The thermodynamic conclusion is likely a general property shared by many ABC transporters. The kinetic bottleneck, however, varies from transporter to transporter. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25696.map.gz emd_25696.map.gz | 51.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25696-v30.xml emd-25696-v30.xml emd-25696.xml emd-25696.xml | 20.4 KB 20.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
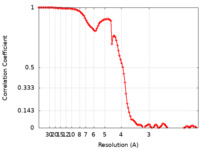
| FSC (解像度算出) |  emd_25696_fsc.xml emd_25696_fsc.xml | 10.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_25696.png emd_25696.png | 53.1 KB | ||
| Filedesc metadata |  emd-25696.cif.gz emd-25696.cif.gz | 6.6 KB | ||
| その他 |  emd_25696_half_map_1.map.gz emd_25696_half_map_1.map.gz emd_25696_half_map_2.map.gz emd_25696_half_map_2.map.gz | 95.4 MB 95.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25696 http://ftp.pdbj.org/pub/emdb/structures/EMD-25696 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25696 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25696 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_25696_validation.pdf.gz emd_25696_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_25696_full_validation.pdf.gz emd_25696_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_25696_validation.xml.gz emd_25696_validation.xml.gz | 18.5 KB | 表示 | |
| CIF形式データ |  emd_25696_validation.cif.gz emd_25696_validation.cif.gz | 23.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25696 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25696 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25696 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25696 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7t56MC  7t54C  7t55C  7t57C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-11010 (タイトル: Cryo-electron microscopy reconstruction of PCAT1 in three distinct inward-facing conformations during ATP turnover condition EMPIAR-11010 (タイトル: Cryo-electron microscopy reconstruction of PCAT1 in three distinct inward-facing conformations during ATP turnover conditionData size: 5.2 TB Data #1: Unaligned, uncorrected movies of PCAT1 in ATP active turnover condition [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25696.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25696.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | full map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.03 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: half map A
| ファイル | emd_25696_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: half map B
| ファイル | emd_25696_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Ternary complex of PCAT1 with its cleaved peptide substrate and ATP-Mg
| 全体 | 名称: Ternary complex of PCAT1 with its cleaved peptide substrate and ATP-Mg |
|---|---|
| 要素 |
|
-超分子 #1: Ternary complex of PCAT1 with its cleaved peptide substrate and ATP-Mg
| 超分子 | 名称: Ternary complex of PCAT1 with its cleaved peptide substrate and ATP-Mg タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Acetivibrio thermocellus (バクテリア) Acetivibrio thermocellus (バクテリア) |
| 分子量 | 理論値: 162.176 KDa |
-分子 #1: ABC-type bacteriocin transporter
| 分子 | 名称: ABC-type bacteriocin transporter / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Acetivibrio thermocellus (バクテリア) Acetivibrio thermocellus (バクテリア)株: ATCC 27405 / DSM 1237 / JCM 9322 / NBRC 103400 / NCIMB 10682 / NRRL B-4536 / VPI 7372 |
| 分子量 | 理論値: 81.180805 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SNAMLRRLFK KKYVCVRQYD LTDCGAACLS SIAQYYGLKM SLAKIREMTG TDTQGTNAYG LIHAAKQLGF SAKGVKASKE DLLKDFRLP AIANVIVDNR LAHFVVIYSI KNRIITVADP GKGIVRYSMD DFCSIWTGGL VLLEPGEAFQ KGDYTQNMMV K FAGFLKPL ...文字列: SNAMLRRLFK KKYVCVRQYD LTDCGAACLS SIAQYYGLKM SLAKIREMTG TDTQGTNAYG LIHAAKQLGF SAKGVKASKE DLLKDFRLP AIANVIVDNR LAHFVVIYSI KNRIITVADP GKGIVRYSMD DFCSIWTGGL VLLEPGEAFQ KGDYTQNMMV K FAGFLKPL KKTVLCIFLA SLLYTALGIA GSFYIKFLFD DLIKFEKLND LHIISAGFAV IFLLQIFLNY YRSILVTKLG MS IDKSIMM EYYSHVLKLP MNFFNSRKVG EIISRFMDAS KIRQAISGAT LTIMIDTIMA VIGGILLYIQ NSSLFFISFI IIL LYGIIV TVFNKPIQNA NRQIMEDNAK LTSALVESVK GIETIKSFGA EEQTEKSTRD KIETVMKSSF KEGMLYINLS SLTG IVAGL GGIVILWAGA YNVIKGNMSG GQLLAFNALL AYFLTPVKNL IDLQPLIQTA VVASNRLGEI LELATEKELR EDSDD FVIS LKGDIEFRNV DFRYGLRKPV LKNINLTIPK GKTVAIVGES GSGKTTLAKL LMNFYSPEKG DILINGHSIK NISLEL IRK KIAFVSQDVF IFSGTVKENL CLGNENVDMD EIIKAAKMAN AHDFIEKLPL KYDTFLNESG ANLSEGQKQR LAIARAL LK KPDILILDEA TSNLDSITEN HIKDAIYGLE DDVTVIIIAH RLSTIVNCDK IYLLKDGEIV ESGSHTELIA LKGCYFKM W KQTENTLAS UniProtKB: ABC-type bacteriocin transporter |
-分子 #2: PCAT1 peptide substrate
| 分子 | 名称: PCAT1 peptide substrate / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Acetivibrio thermocellus (バクテリア) Acetivibrio thermocellus (バクテリア)株: ATCC 27405 / DSM 1237 / JCM 9322 / NBRC 103400 / NCIMB 10682 / NRRL B-4536 / VPI 7372 |
| 分子量 | 理論値: 10.217867 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SNAMSEAKKL NIGRELTDEE LMEMTGGSTF SIQCQKDYTY KPSLPVVKYG VVIDEPEVVI KYGVGPIVGI KYGVEPIGPI QPMYGIKPV ETLK UniProtKB: Bacteriocin-type signal sequence-containing protein |
-分子 #3: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 2 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 7 mg/mL | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7 構成要素:
| ||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. / 前処理 - 雰囲気: AIR | ||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 100.0 K |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - 画像ごとのフレーム数: 1-50 / 撮影したグリッド数: 2 / 実像数: 11966 / 平均露光時間: 0.2 sec. / 平均電子線量: 1.5 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)