+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-21489 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | cryo-EM structure of Sth1-Arp7-Arp9-Rtt102 | |||||||||
 マップデータ マップデータ | Cryo-EM map of Sth1-Arp7-Arp9-Rtt102 complex; unsharpened map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Chromatin remodeling / Nucleosome / Gene Regulation / MOTOR PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報RHO GTPases activate IQGAPs / RHO GTPases Activate WASPs and WAVEs / Regulation of actin dynamics for phagocytic cup formation / chromatin remodeling at centromere / Platelet degranulation / DNA translocase activity / RSC-type complex / SWI/SNF complex / nucleosome disassembly / ATP-dependent chromatin remodeler activity ...RHO GTPases activate IQGAPs / RHO GTPases Activate WASPs and WAVEs / Regulation of actin dynamics for phagocytic cup formation / chromatin remodeling at centromere / Platelet degranulation / DNA translocase activity / RSC-type complex / SWI/SNF complex / nucleosome disassembly / ATP-dependent chromatin remodeler activity / NuA4 histone acetyltransferase complex / chromosome, centromeric region / ATP-dependent activity, acting on DNA / meiotic cell cycle / cytoskeleton organization / lysine-acetylated histone binding / helicase activity / chromosome segregation / transcription elongation by RNA polymerase II / base-excision repair / double-strand break repair / chromatin organization / DNA helicase / chromatin remodeling / chromatin binding / regulation of transcription by RNA polymerase II / chromatin / regulation of DNA-templated transcription / structural molecule activity / positive regulation of transcription by RNA polymerase II / ATP hydrolysis activity / DNA binding / ATP binding / nucleus 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
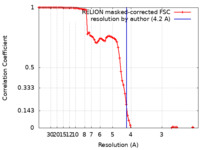
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.2 Å | |||||||||
 データ登録者 データ登録者 | Leschziner AE / Baker RW | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2021 ジャーナル: Nat Struct Mol Biol / 年: 2021タイトル: Structural insights into assembly and function of the RSC chromatin remodeling complex. 著者: Richard W Baker / Janice M Reimer / Peter J Carman / Bengi Turegun / Tsutomu Arakawa / Roberto Dominguez / Andres E Leschziner /  要旨: SWI/SNF chromatin remodelers modify the position and spacing of nucleosomes and, in humans, are linked to cancer. To provide insights into the assembly and regulation of this protein family, we ...SWI/SNF chromatin remodelers modify the position and spacing of nucleosomes and, in humans, are linked to cancer. To provide insights into the assembly and regulation of this protein family, we focused on a subcomplex of the Saccharomyces cerevisiae RSC comprising its ATPase (Sth1), the essential actin-related proteins (ARPs) Arp7 and Arp9 and the ARP-binding protein Rtt102. Cryo-EM and biochemical analyses of this subcomplex shows that ARP binding induces a helical conformation in the helicase-SANT-associated (HSA) domain of Sth1. Surprisingly, the ARP module is rotated 120° relative to the full RSC about a pivot point previously identified as a regulatory hub in Sth1, suggesting that large conformational changes are part of Sth1 regulation and RSC assembly. We also show that a conserved interaction between Sth1 and the nucleosome acidic patch enhances remodeling. As some cancer-associated mutations dysregulate rather than inactivate SWI/SNF remodelers, our insights into RSC complex regulation advance a mechanistic understanding of chromatin remodeling in disease states. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_21489.map.gz emd_21489.map.gz | 40.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-21489-v30.xml emd-21489-v30.xml emd-21489.xml emd-21489.xml | 24.4 KB 24.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_21489_fsc.xml emd_21489_fsc.xml | 8.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_21489.png emd_21489.png | 49.3 KB | ||
| Filedesc metadata |  emd-21489.cif.gz emd-21489.cif.gz | 7.6 KB | ||
| その他 |  emd_21489_additional_1.map.gz emd_21489_additional_1.map.gz emd_21489_half_map_1.map.gz emd_21489_half_map_1.map.gz emd_21489_half_map_2.map.gz emd_21489_half_map_2.map.gz | 49.3 MB 40.7 MB 40.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-21489 http://ftp.pdbj.org/pub/emdb/structures/EMD-21489 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21489 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21489 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_21489_validation.pdf.gz emd_21489_validation.pdf.gz | 692.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_21489_full_validation.pdf.gz emd_21489_full_validation.pdf.gz | 692.3 KB | 表示 | |
| XML形式データ |  emd_21489_validation.xml.gz emd_21489_validation.xml.gz | 14.3 KB | 表示 | |
| CIF形式データ |  emd_21489_validation.cif.gz emd_21489_validation.cif.gz | 20.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21489 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21489 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21489 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21489 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_21489.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_21489.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM map of Sth1-Arp7-Arp9-Rtt102 complex; unsharpened map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.16 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: Cryo-EM map of Sth1-Arp7-Arp9-Rtt102 complex; sharpened map
| ファイル | emd_21489_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM map of Sth1-Arp7-Arp9-Rtt102 complex; sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Cryo-EM map of Sth1-Arp7-Arp9-Rtt102 complex; half map 1
| ファイル | emd_21489_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM map of Sth1-Arp7-Arp9-Rtt102 complex; half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Cryo-EM map of Sth1-Arp7-Arp9-Rtt102 complex; half map 2
| ファイル | emd_21489_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM map of Sth1-Arp7-Arp9-Rtt102 complex; half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : cryo-EM structure of Sth1-Arp7-Arp9-Rtt102
| 全体 | 名称: cryo-EM structure of Sth1-Arp7-Arp9-Rtt102 |
|---|---|
| 要素 |
|
-超分子 #1: cryo-EM structure of Sth1-Arp7-Arp9-Rtt102
| 超分子 | 名称: cryo-EM structure of Sth1-Arp7-Arp9-Rtt102 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 200 KDa |
-分子 #1: Actin-related protein 7
| 分子 | 名称: Actin-related protein 7 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 53.863016 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTLNRKCVVI HNGSHRTVAG FSNVELPQCI IPSSYIKRTD EGGEAEFIFG TYNMIDAAAE KRNGDEVYTL VDSQGLPYNW DALEMQWRY LYDTQLKVSP EELPLVITMP ATNGKPDMAI LERYYELAFD KLNVPVFQIV IEPLAIALSM GKSSAFVIDI G ASGCNVTP ...文字列: MTLNRKCVVI HNGSHRTVAG FSNVELPQCI IPSSYIKRTD EGGEAEFIFG TYNMIDAAAE KRNGDEVYTL VDSQGLPYNW DALEMQWRY LYDTQLKVSP EELPLVITMP ATNGKPDMAI LERYYELAFD KLNVPVFQIV IEPLAIALSM GKSSAFVIDI G ASGCNVTP IIDGIVVKNA VVRSKFGGDF LDFQVHERLA PLIKEENDME NMADEQKRST DVWYEASTWI QQFKSTMLQV SE KDLFELE RYYKEQADIY AKQQEQLKQM DQQLQYTALT GSPNNPLVQK KNFLFKPLNK TLTLDLKECY QFAEYLFKPQ LIS DKFSPE DGLGPLMAKS VKKAGASINS MKANTSTNPN GLGTSHINTN VGDNNSTASS SNISPEQVYS LLLTNVIITG STSL IEGME QRIIKELSIR FPQYKLTTFA NQVMMDRKIQ GWLGALTMAN LPSWSLGKWY SKEDYETLKR DRKQSQATNA TN UniProtKB: Actin-related protein 7 |
-分子 #2: Actin-like protein ARP9
| 分子 | 名称: Actin-like protein ARP9 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 53.13193 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAPFRQDSIL IIYPRSQTTL VQFGLNEETF TVPELEIPTQ IYRTTRQDGS YTYHSTNKDN KAELIKPIQN GEIIDISAFT QFLRLIFVS ILSDRANKNQ DAFEAELSNI PLLLITHHSW SQSDLEIITQ YVFESLEINN LIQLPASLAA TYSMISLQNC C IIDVGTHH ...文字列: MAPFRQDSIL IIYPRSQTTL VQFGLNEETF TVPELEIPTQ IYRTTRQDGS YTYHSTNKDN KAELIKPIQN GEIIDISAFT QFLRLIFVS ILSDRANKNQ DAFEAELSNI PLLLITHHSW SQSDLEIITQ YVFESLEINN LIQLPASLAA TYSMISLQNC C IIDVGTHH TDIIPIVDYA QLDHLVSSIP MGGQSINDSL KKLLPQWDDD QIESLKKSPI FEVLSDDAKK LSSFDFGNEN ED EDEGTLN VAEIITSGRD TREVLEERER GQKVKNVKNS DLEFNTFWDE KGNEIKVGKQ RFQGCNNLIK NISNRVGLTL DNI DDINKA KAVWENIIIV GGTTSISGFK EALLGQLLKD HLIIEPEEEK SKREEEAKSV LPAATKKKSK FMTNSTAFVP TIEY VQCPT VIKLAKYPDY FPEWKKSGYS EIIFLGAQIV SKQIFTHPKD TFYITREKYN MKGPAALWDV QF UniProtKB: Actin-like protein ARP9 |
-分子 #3: Nuclear protein STH1/NPS1
| 分子 | 名称: Nuclear protein STH1/NPS1 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO / EC番号: DNA helicase |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 95.077289 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGSSHHHHHH SQDPNSVRLA EELERQQLLE KRKKERNLHL QKINSIIDFI KERQSEQWSR QERCFQFGRL GASLHNQMEK DEQKRIEKT AKQRLAALKS NDEEAYLKLL DQTKDTRITQ LLRQTNSFLD SLSEAVRAQQ NEAKILHGEE VQPITDEERE K TDYYEVAH ...文字列: MGSSHHHHHH SQDPNSVRLA EELERQQLLE KRKKERNLHL QKINSIIDFI KERQSEQWSR QERCFQFGRL GASLHNQMEK DEQKRIEKT AKQRLAALKS NDEEAYLKLL DQTKDTRITQ LLRQTNSFLD SLSEAVRAQQ NEAKILHGEE VQPITDEERE K TDYYEVAH RIKEKIDKQP SILVGGTLKE YQLRGLEWMV SLYNNHLNGI LADEMGLGKT IQSISLITYL YEVKKDIGPF LV IVPLSTI TNWTLEFEKW APSLNTIIYK GTPNQRHSLQ HQIRVGNFDV LLTTYEYIIK DKSLLSKHDW AHMIIDEGHR MKN AQSKLS FTISHYYRTR NRLILTGTPL QNNLPELWAL LNFVLPKIFN SAKTFEDWFN TPFANTGTQE KLELTEEETL LIIR RLHKV LRPFLLRRLK KEVEKDLPDK VEKVIKCKLS GLQQQLYQQM LKHNALFVGA GTEGATKGGI KGLNNKIMQL RKICN HPFV FDEVEGVVNP SRGNSDLLFR VAGKFELLDR VLPKFKASGH RVLMFFQMTQ VMDIMEDFLR MKDLKYMRLD GSTKTE ERT EMLNAFNAPD SDYFCFLLST RAGGLGLNLQ TADTVIIFDT DWNPHQDLQA QDRAHRIGQK NEVRILRLIT TDSVEEV IL ERAMQKLDID GKVIQAGKFD NKSTAEEQEA FLRRLIESET NRDDDDKAEL DDDELNDTLA RSADEKILFD KIDKERMN Q ERADAKAQGL RVPPPRLIQL DELPKVFRED IEEHFKKEDS EPLGRIRQKK RVYYDDGLTE EQFLEAVEDD NMSLEDAIK KRREARERRR LRQ UniProtKB: Nuclear protein STH1/NPS1 |
-分子 #4: Regulator of Ty1 transposition protein 102
| 分子 | 名称: Regulator of Ty1 transposition protein 102 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 17.817615 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDPQTLITKA NKVSYYGNPT SKESWRYDWY QPSKVSSNVQ QPQQQLGDME NNLEKYPFRY KTWLRNQEDE KNLQRESCED ILDLKEFDR RILKKSLMTS HTKGDTSKAT GAPSANQGDE ALSVDDIRGA VGNSEAIPGL SAGVNNDNTK ESKDVKMN UniProtKB: Regulator of Ty1 transposition protein 102 |
-分子 #5: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 1 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. / 前処理 - 雰囲気: AIR / 詳細: Glow discharge for 20 seconds, 20 mAmp |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV / 詳細: 4 second blot time, blot force 20. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 特殊光学系 | 位相板: VOLTA PHASE PLATE |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均露光時間: 7.0 sec. / 平均電子線量: 53.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 36000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||
|---|---|---|---|---|---|---|---|
| 詳細 | Initial model docking was done in Chimera. Sth1-Arp7-Arp9-Rtt102 were refined in Rosetta and the top ten models were deposited. | ||||||
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT | ||||||
| 得られたモデル |  PDB-6vzg: |
 ムービー
ムービー コントローラー
コントローラー




















 Z
Z Y
Y X
X