+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 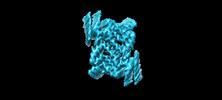 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Alpha-synuclein amyloid fibrils | ||||||||||||
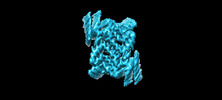
 マップデータ マップデータ | Postprocessed map of the alpha-synuclein amyloid fibril core | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Chaperones / amyloid fibril / PROTEIN FIBRIL | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of mitochondrial electron transport, NADH to ubiquinone / neutral lipid metabolic process / regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process ...negative regulation of mitochondrial electron transport, NADH to ubiquinone / neutral lipid metabolic process / regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process / supramolecular fiber / negative regulation of transporter activity / mitochondrial membrane organization / negative regulation of chaperone-mediated autophagy / regulation of reactive oxygen species biosynthetic process / positive regulation of protein localization to cell periphery / regulation of synaptic vesicle recycling / negative regulation of platelet-derived growth factor receptor signaling pathway / negative regulation of exocytosis / regulation of glutamate secretion / regulation of norepinephrine uptake / response to iron(II) ion / SNARE complex assembly / positive regulation of neurotransmitter secretion / dopamine biosynthetic process / regulation of locomotion / positive regulation of inositol phosphate biosynthetic process / synaptic vesicle priming / regulation of macrophage activation / negative regulation of microtubule polymerization / dopamine uptake involved in synaptic transmission / synaptic vesicle transport / dynein complex binding / positive regulation of receptor recycling / regulation of dopamine secretion / protein kinase inhibitor activity / negative regulation of thrombin-activated receptor signaling pathway / response to type II interferon / cuprous ion binding / positive regulation of exocytosis / synaptic vesicle exocytosis / kinesin binding / positive regulation of endocytosis / mitochondrial ATP synthesis coupled electron transport / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / response to magnesium ion / regulation of presynapse assembly / synaptic vesicle endocytosis / negative regulation of serotonin uptake / alpha-tubulin binding / localization / phospholipid metabolic process / supramolecular fiber organization / axon terminus / inclusion body / cellular response to copper ion / cellular response to epinephrine stimulus / Hsp70 protein binding / excitatory postsynaptic potential / response to interleukin-1 / adult locomotory behavior / SNARE binding / positive regulation of release of sequestered calcium ion into cytosol / fatty acid metabolic process / long-term synaptic potentiation / phosphoprotein binding / protein tetramerization / regulation of transmembrane transporter activity / synapse organization / regulation of long-term neuronal synaptic plasticity / microglial cell activation / negative regulation of protein kinase activity / protein destabilization / negative regulation of cysteine-type endopeptidase activity involved in apoptotic process / ferrous iron binding / tau protein binding / PKR-mediated signaling / positive regulation of protein serine/threonine kinase activity / receptor internalization / phospholipid binding / synaptic vesicle membrane / positive regulation of inflammatory response / activation of cysteine-type endopeptidase activity involved in apoptotic process / actin cytoskeleton / positive regulation of peptidyl-serine phosphorylation / actin binding / cell cortex / histone binding / cellular response to oxidative stress / growth cone / postsynapse / chemical synaptic transmission / neuron apoptotic process / negative regulation of neuron apoptotic process / amyloid fibril formation / response to lipopolysaccharide / molecular adaptor activity / oxidoreductase activity / lysosome / transcription cis-regulatory region binding 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
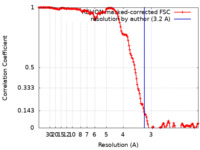
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | ||||||||||||
 データ登録者 データ登録者 | Saibil HR / Monistrol J | ||||||||||||
| 資金援助 |  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Biorxiv / 年: 2024 ジャーナル: Biorxiv / 年: 2024タイトル: Stepwise recruitment of Hsc70 by DNAJB1 produces ordered arrays primed for bursts of amyloid fibre disassembly 著者: Monistrol J / Beton JG / Johnston EC / Saibil HR | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_19446.map.gz emd_19446.map.gz | 16.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-19446-v30.xml emd-19446-v30.xml emd-19446.xml emd-19446.xml | 16.3 KB 16.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_19446_fsc.xml emd_19446_fsc.xml | 14.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_19446.png emd_19446.png | 26.9 KB | ||
| マスクデータ |  emd_19446_msk_1.map emd_19446_msk_1.map | 282.6 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-19446.cif.gz emd-19446.cif.gz | 5.7 KB | ||
| その他 |  emd_19446_half_map_1.map.gz emd_19446_half_map_1.map.gz emd_19446_half_map_2.map.gz emd_19446_half_map_2.map.gz | 223.3 MB 223.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-19446 http://ftp.pdbj.org/pub/emdb/structures/EMD-19446 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19446 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19446 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_19446_validation.pdf.gz emd_19446_validation.pdf.gz | 625.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_19446_full_validation.pdf.gz emd_19446_full_validation.pdf.gz | 625.5 KB | 表示 | |
| XML形式データ |  emd_19446_validation.xml.gz emd_19446_validation.xml.gz | 22.5 KB | 表示 | |
| CIF形式データ |  emd_19446_validation.cif.gz emd_19446_validation.cif.gz | 29.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19446 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19446 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19446 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19446 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8rqmMC  8rrrC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_19446.map.gz / 形式: CCP4 / 大きさ: 282.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_19446.map.gz / 形式: CCP4 / 大きさ: 282.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Postprocessed map of the alpha-synuclein amyloid fibril core | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_19446_msk_1.map emd_19446_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Unfiltered half map #1 of the alpha-synuclein amyloid fibril core
| ファイル | emd_19446_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unfiltered half map #1 of the alpha-synuclein amyloid fibril core | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Unfiltered half map #2 of the alpha-synuclein amyloid fibril core
| ファイル | emd_19446_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unfiltered half map #2 of the alpha-synuclein amyloid fibril core | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Alpha-synuclein amyloid fibril
| 全体 | 名称: Alpha-synuclein amyloid fibril |
|---|---|
| 要素 |
|
-超分子 #1: Alpha-synuclein amyloid fibril
| 超分子 | 名称: Alpha-synuclein amyloid fibril / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Alpha-synuclein
| 分子 | 名称: Alpha-synuclein / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 14.476108 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDVFMKGLSK AKEGVVAAAE KTKQGVAEAA GKTKEGVLYV GSKTKEGVVH GVATVAEKTK EQVTNVGGAV VTGVTAVAQK TVEGAGSIA AATGFVKKDQ LGKNEEGAPQ EGILEDMPVD PDNEAYEMPS EEGYQDYEPE A UniProtKB: Alpha-synuclein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: C-flat-2/2 / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE | |||||||||
| 凍結 | 凍結剤: ETHANE / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 49.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー










 Z
Z Y
Y X
X