登録情報 データベース : PDB / ID : 7vktタイトル cryo-EM structure of LTB4-bound BLT1 in complex with Gi protein (Guanine nucleotide-binding protein ...) x 3 Leukotriene B4 receptor 1 scFv16 キーワード / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 2.9 Å データ登録者 He, Y. / Wang, N. 資金援助 組織 認可番号 国 National Natural Science Foundation of China (NSFC) 32070048
ジャーナル : Nat Commun / 年 : 2022タイトル : Structural basis of leukotriene B4 receptor 1 activation.著者 : Na Wang / Xinheng He / Jing Zhao / Hualiang Jiang / Xi Cheng / Yu Xia / H Eric Xu / Yuanzheng He / 要旨 : Leukotriene B4 receptor 1 (BLT1) plays crucial roles in the acute inflammatory responses and is a valuable target for anti-inflammation treatment, however, the mechanism by which leukotriene B4 (LTB4) ... Leukotriene B4 receptor 1 (BLT1) plays crucial roles in the acute inflammatory responses and is a valuable target for anti-inflammation treatment, however, the mechanism by which leukotriene B4 (LTB4) activates receptor remains unclear. Here, we report the cryo-electron microscopy (cryo-EM) structure of the LTB4 -bound human BLT1 in complex with a G protein in an active conformation at resolution of 2.91 Å. In combination of molecule dynamics (MD) simulation, docking and site-directed mutagenesis, our structure reveals that a hydrogen-bond network of water molecules and key polar residues is the key molecular determinant for LTB4 binding. We also find that the displacement of residues M101 and I271 to the center of receptor, which unlock the ion lock of the lower part of pocket, is the key mechanism of receptor activation. In addition, we reveal a binding site of phosphatidylinositol (PI) and discover that the widely open ligand binding pocket may contribute the lack of specificity and efficacy for current BLT1-targeting drug design. Taken together, our structural analysis provides a scaffold for understanding BLT1 activation and a rational basis for designing anti-leukotriene drugs. 履歴 登録 2021年10月1日 登録サイト / 処理サイト 改定 1.0 2022年3月9日 Provider / タイプ 改定 1.1 2022年3月23日 Group / カテゴリ / citation_authorItem _citation.country / _citation.journal_abbrev ... _citation.country / _citation.journal_abbrev / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 中国, 1件
中国, 1件  引用
引用 ジャーナル: Nat Commun / 年: 2022
ジャーナル: Nat Commun / 年: 2022
 構造の表示
構造の表示 ムービービューア
ムービービューア Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7vkt.cif.gz
7vkt.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7vkt.ent.gz
pdb7vkt.ent.gz PDB形式
PDB形式 7vkt.json.gz
7vkt.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 7vkt_validation.pdf.gz
7vkt_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 7vkt_full_validation.pdf.gz
7vkt_full_validation.pdf.gz 7vkt_validation.xml.gz
7vkt_validation.xml.gz 7vkt_validation.cif.gz
7vkt_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/vk/7vkt
https://data.pdbj.org/pub/pdb/validation_reports/vk/7vkt ftp://data.pdbj.org/pub/pdb/validation_reports/vk/7vkt
ftp://data.pdbj.org/pub/pdb/validation_reports/vk/7vkt リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: GNAI1 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: GNAI1 / 発現宿主:  Insect BA phytoplasma (バクテリア) / 参照: UniProt: P63096
Insect BA phytoplasma (バクテリア) / 参照: UniProt: P63096 Homo sapiens (ヒト) / 遺伝子: GNB1 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: GNB1 / 発現宿主:  Insect BA phytoplasma (バクテリア) / 参照: UniProt: P62873
Insect BA phytoplasma (バクテリア) / 参照: UniProt: P62873 Homo sapiens (ヒト) / 遺伝子: GNG2 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: GNG2 / 発現宿主:  Insect BA phytoplasma (バクテリア) / 参照: UniProt: P59768
Insect BA phytoplasma (バクテリア) / 参照: UniProt: P59768 Homo sapiens (ヒト) / 遺伝子: LTB4R, BLT, BLT1, BLTR, CMKRL1, GPR16, P2RY7 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: LTB4R, BLT, BLT1, BLTR, CMKRL1, GPR16, P2RY7 / 発現宿主:  Insect BA phytoplasma (バクテリア) / 参照: UniProt: Q15722
Insect BA phytoplasma (バクテリア) / 参照: UniProt: Q15722 Homo sapiens (ヒト) / 発現宿主:
Homo sapiens (ヒト) / 発現宿主:  Insect BA phytoplasma (バクテリア)
Insect BA phytoplasma (バクテリア)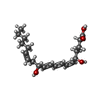






 試料調製
試料調製 Homo sapiens (ヒト)
Homo sapiens (ヒト) Insect BA phytoplasma (バクテリア)
Insect BA phytoplasma (バクテリア) 電子顕微鏡撮影
電子顕微鏡撮影
 FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER
FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER 解析
解析 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj

































