+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6vs6 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Mycobacterium tuberculosis dihydrofolate reductase in complex with 3-(furan-2-yl)-1-methyl-1H-pyrazole-5-carboxylic acid (fragment 2) | ||||||
 要素 要素 | Dihydrofolate reductase | ||||||
 キーワード キーワード | BIOSYNTHETIC PROTEIN / folate pathway | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報NADP+ binding / dihydrofolate metabolic process / glycine biosynthetic process / dihydrofolate reductase / dihydrofolate reductase activity / folic acid metabolic process / tetrahydrofolate biosynthetic process / one-carbon metabolic process / NADP binding / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.853 Å 分子置換 / 解像度: 1.853 Å | ||||||
 データ登録者 データ登録者 | Ribeiro, J.A. / Dias, M.V.B. | ||||||
| 資金援助 |  ブラジル, 1件 ブラジル, 1件
| ||||||
 引用 引用 |  ジャーナル: Acs Infect Dis. / 年: 2020 ジャーナル: Acs Infect Dis. / 年: 2020タイトル: Using a Fragment-Based Approach to Identify Alternative Chemical Scaffolds Targeting Dihydrofolate Reductase fromMycobacterium tuberculosis. 著者: Ribeiro, J.A. / Hammer, A. / Libreros-Zuniga, G.A. / Chavez-Pacheco, S.M. / Tyrakis, P. / de Oliveira, G.S. / Kirkman, T. / El Bakali, J. / Rocco, S.A. / Sforca, M.L. / Parise-Filho, R. / ...著者: Ribeiro, J.A. / Hammer, A. / Libreros-Zuniga, G.A. / Chavez-Pacheco, S.M. / Tyrakis, P. / de Oliveira, G.S. / Kirkman, T. / El Bakali, J. / Rocco, S.A. / Sforca, M.L. / Parise-Filho, R. / Coyne, A.G. / Blundell, T.L. / Abell, C. / Dias, M.V.B. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6vs6.cif.gz 6vs6.cif.gz | 158.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6vs6.ent.gz pdb6vs6.ent.gz | 122.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6vs6.json.gz 6vs6.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6vs6_validation.pdf.gz 6vs6_validation.pdf.gz | 517.6 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6vs6_full_validation.pdf.gz 6vs6_full_validation.pdf.gz | 520.9 KB | 表示 | |
| XML形式データ |  6vs6_validation.xml.gz 6vs6_validation.xml.gz | 2.7 KB | 表示 | |
| CIF形式データ |  6vs6_validation.cif.gz 6vs6_validation.cif.gz | 7.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/vs/6vs6 https://data.pdbj.org/pub/pdb/validation_reports/vs/6vs6 ftp://data.pdbj.org/pub/pdb/validation_reports/vs/6vs6 ftp://data.pdbj.org/pub/pdb/validation_reports/vs/6vs6 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6vs5C  6vs8C  6vs9C  6vsdC  6vseC  6vsfC  6vsgC  6vv6C  6vv7C  6vv8C  6vv9C  6vvbC  1df7S S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 | 分子量: 17893.293 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: folA, ERS023446_01268, ERS027651_02380, SAMEA2682864_02011, SAMEA2683035_01637 発現宿主:  参照: UniProt: A0A0E8UVJ4, UniProt: P9WNX1*PLUS, dihydrofolate reductase |
|---|
-非ポリマー , 5種, 282分子 

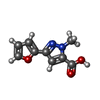






| #2: 化合物 | | #3: 化合物 | #4: 化合物 | #5: 化合物 | #6: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.15 Å3/Da / 溶媒含有率: 42.89 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 詳細: 1.6 M ammonium sulfate, 100 mM MES (2-(N-morpholino) ethanesulfonic acid), pH 6.5, 10 mM CoCl2 |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  LNLS LNLS  / ビームライン: W01B-MX2 / 波長: 1.4 Å / ビームライン: W01B-MX2 / 波長: 1.4 Å | ||||||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS PILATUS 2M / 検出器: PIXEL / 日付: 2017年3月23日 | ||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||
| 放射波長 | 波長: 1.4 Å / 相対比: 1 | ||||||||||||||||||||||||||||||
| Reflection twin | Operator: -h,l,k / Fraction: 0.28 | ||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.85→46.46 Å / Num. obs: 26688 / % possible obs: 98.9 % / 冗長度: 10 % / CC1/2: 0.996 / Rmerge(I) obs: 0.137 / Rpim(I) all: 0.044 / Rrim(I) all: 0.144 / Net I/σ(I): 12.5 / Num. measured all: 266847 / Scaling rejects: 73 | ||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 1df7 解像度: 1.853→46.456 Å / 交差検証法: THROUGHOUT / σ(F): 1.34 / 位相誤差: 28.03
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 83.65 Å2 / Biso mean: 26.3609 Å2 / Biso min: 11.65 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.853→46.456 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 9
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Origin x: 53.5052 Å / Origin y: 70.4375 Å / Origin z: 17.999 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj






