[English] 日本語
 Yorodumi
Yorodumi- PDB-3odu: The 2.5 A structure of the CXCR4 chemokine receptor in complex wi... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 3odu | ||||||
|---|---|---|---|---|---|---|---|
| Title | The 2.5 A structure of the CXCR4 chemokine receptor in complex with small molecule antagonist IT1t | ||||||
 Components Components | C-X-C chemokine receptor type 4, Lysozyme Chimera | ||||||
 Keywords Keywords | SIGNALING PROTEIN / HYDROLASE / Structural Genomics / PSI-2 / Protein Structure Initiative / Accelerated Technologies Center for Gene to 3D Structure / ATCG3D / 7TM / G protein-coupled receptor / GPCR / Signal transduction / Cancer / HIV-1 co-receptor / chemokine / CXCL12 / SDF1 / isothiourea / Chimera / T4L Fusion / Membrane protein / Transmembrane / SINGNALING PROTEIN / PSI-Biology / GPCR Network | ||||||
| Function / homology |  Function and homology information Function and homology informationC-X-C motif chemokine 12 receptor activity / positive regulation of macrophage migration inhibitory factor signaling pathway / myosin light chain binding / CXCL12-activated CXCR4 signaling pathway / Specification of primordial germ cells / myelin maintenance / C-X-C chemokine receptor activity / positive regulation of vasculature development / Signaling by ROBO receptors / regulation of chemotaxis ...C-X-C motif chemokine 12 receptor activity / positive regulation of macrophage migration inhibitory factor signaling pathway / myosin light chain binding / CXCL12-activated CXCR4 signaling pathway / Specification of primordial germ cells / myelin maintenance / C-X-C chemokine receptor activity / positive regulation of vasculature development / Signaling by ROBO receptors / regulation of chemotaxis / Formation of definitive endoderm / C-C chemokine receptor activity / Developmental Lineage of Pancreatic Acinar Cells / C-C chemokine binding / anchoring junction / Chemokine receptors bind chemokines / dendritic cell chemotaxis / cellular response to cytokine stimulus / cell leading edge / positive regulation of oligodendrocyte differentiation / Binding and entry of HIV virion / regulation of cell adhesion / viral release from host cell by cytolysis / coreceptor activity / peptidoglycan catabolic process / neurogenesis / ubiquitin binding / cell chemotaxis / calcium-mediated signaling / brain development / G protein-coupled receptor activity / response to virus / cell wall macromolecule catabolic process / lysozyme / lysozyme activity / late endosome / positive regulation of cold-induced thermogenesis / actin binding / positive regulation of cytosolic calcium ion concentration / virus receptor activity / cytoplasmic vesicle / G alpha (i) signalling events / host cell cytoplasm / response to hypoxia / early endosome / lysosome / defense response to bacterium / positive regulation of cell migration / immune response / G protein-coupled receptor signaling pathway / inflammatory response / external side of plasma membrane / apoptotic process / ubiquitin protein ligase binding / cell surface / protein-containing complex / extracellular exosome / plasma membrane / cytoplasm Similarity search - Function | ||||||
| Biological species |  Homo Sapiens (human) Homo Sapiens (human) Enterobacteria phage T4 (virus) Enterobacteria phage T4 (virus) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.5 Å MOLECULAR REPLACEMENT / Resolution: 2.5 Å | ||||||
 Authors Authors | Wu, B. / Mol, C.D. / Han, G.W. / Katritch, V. / Chien, E.Y.T. / Liu, W. / Cherezov, V. / Stevens, R.C. / Accelerated Technologies Center for Gene to 3D Structure (ATCG3D) / GPCR Network (GPCR) | ||||||
 Citation Citation |  Journal: Science / Year: 2010 Journal: Science / Year: 2010Title: Structures of the CXCR4 chemokine GPCR with small-molecule and cyclic peptide antagonists. Authors: Wu, B. / Chien, E.Y. / Mol, C.D. / Fenalti, G. / Liu, W. / Katritch, V. / Abagyan, R. / Brooun, A. / Wells, P. / Bi, F.C. / Hamel, D.J. / Kuhn, P. / Handel, T.M. / Cherezov, V. / Stevens, R.C. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  3odu.cif.gz 3odu.cif.gz | 385.4 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb3odu.ent.gz pdb3odu.ent.gz | 316 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  3odu.json.gz 3odu.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/od/3odu https://data.pdbj.org/pub/pdb/validation_reports/od/3odu ftp://data.pdbj.org/pub/pdb/validation_reports/od/3odu ftp://data.pdbj.org/pub/pdb/validation_reports/od/3odu | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  3oe0C  3oe6C  3oe8C  3oe9C C: citing same article ( |
|---|---|
| Similar structure data | |
| Other databases |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
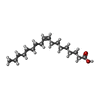
| #1: Protein | Mass: 56962.801 Da / Num. of mol.: 2 Fragment: CXCR4 residues 2-229, LYSOZYME residues 1002-1161, CXCR4 residues 230-319 Mutation: L125W, C1054T, C1097T Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo Sapiens (human), (gene. exp.) Homo Sapiens (human), (gene. exp.)  Enterobacteria phage T4 (virus) Enterobacteria phage T4 (virus)Gene: CXCR4, CXCR4_HUMAN, E / Plasmid: pFastBac / Production host:  #2: Chemical | #3: Chemical | ChemComp-OLC / ( #4: Chemical | ChemComp-OLA / #5: Water | ChemComp-HOH / | Has protein modification | Y | Sequence details | THE PROTEIN IS A FUSION PROTEIN WITH RESIDUES ASN1002-TYR1161 OF T4 LYSOZYME INSERTED BETWEEN ...THE PROTEIN IS A FUSION PROTEIN WITH RESIDUES ASN1002-TYR1161 OF T4 LYSOZYME INSERTED BETWEEN SER229 AND LYS230 OF CXCR4, AS INDICATED AS CXCR4-2 IN THE PUBLICATIO | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 2 X-RAY DIFFRACTION / Number of used crystals: 2 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.78 Å3/Da / Density % sol: 55.77 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: lipidic cubic phase / pH: 5.5 Details: Lipidic cubic phase made of monoolein and cholesterol, 20% PEG400, 0.3M Sodium malonate, 5mM Taurine, 0.1M Sodium citrate, pH 5.5, LIPIDIC CUBIC PHASE, temperature 293K |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  APS APS  / Beamline: 23-ID-D / Wavelength: 1.033 Å / Beamline: 23-ID-D / Wavelength: 1.033 Å |
| Detector | Type: MARMOSAIC 300 mm CCD / Detector: CCD / Date: Jun 12, 2010 / Details: mirrors |
| Radiation | Monochromator: DOUBLE CRYSTAL / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.033 Å / Relative weight: 1 |
| Reflection | Resolution: 2.5→50 Å / Num. obs: 41569 / % possible obs: 95.8 % / Redundancy: 2.3 % / Biso Wilson estimate: 48.57 Å2 / Rmerge(I) obs: 0.12 / Net I/σ(I): 7.2 |
| Reflection shell | Resolution: 2.5→2.59 Å / Redundancy: 1.9 % / Rmerge(I) obs: 0.49 / Mean I/σ(I) obs: 1.8 / % possible all: 89 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT / Resolution: 2.5→19.98 Å / Cor.coef. Fo:Fc: 0.8957 / Cor.coef. Fo:Fc free: 0.8559 / Cross valid method: THROUGHOUT / σ(F): 0 / Stereochemistry target values: Engh & Huber MOLECULAR REPLACEMENT / Resolution: 2.5→19.98 Å / Cor.coef. Fo:Fc: 0.8957 / Cor.coef. Fo:Fc free: 0.8559 / Cross valid method: THROUGHOUT / σ(F): 0 / Stereochemistry target values: Engh & Huber
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 43.79 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.375 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.5→19.98 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.5→2.56 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj