+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3768 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of a pre-catalytic human spliceosome primed for activation (B complex). Unmasked refinement, sharpened map | |||||||||
 マップデータ マップデータ | sharpened, unmasked refinement. Map was aligned to high resolution map (EMDB 3766) and RESAMPLED from 256 px boxsize to 432 px boxsize in Chimera to fit high-resolution map. | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.5 Å | |||||||||
 データ登録者 データ登録者 | Bertram K | |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2017 ジャーナル: Cell / 年: 2017タイトル: Cryo-EM Structure of a Pre-catalytic Human Spliceosome Primed for Activation. 著者: Karl Bertram / Dmitry E Agafonov / Olexandr Dybkov / David Haselbach / Majety N Leelaram / Cindy L Will / Henning Urlaub / Berthold Kastner / Reinhard Lührmann / Holger Stark /  要旨: Little is known about the spliceosome's structure before its extensive remodeling into a catalytically active complex. Here, we report a 3D cryo-EM structure of a pre-catalytic human spliceosomal B ...Little is known about the spliceosome's structure before its extensive remodeling into a catalytically active complex. Here, we report a 3D cryo-EM structure of a pre-catalytic human spliceosomal B complex. The U2 snRNP-containing head domain is connected to the B complex main body via three main bridges. U4/U6.U5 tri-snRNP proteins, which are located in the main body, undergo significant rearrangements during tri-snRNP integration into the B complex. These include formation of a partially closed Prp8 conformation that creates, together with Dim1, a 5' splice site (ss) binding pocket, displacement of Sad1, and rearrangement of Brr2 such that it contacts its U4/U6 substrate and is poised for the subsequent spliceosome activation step. The molecular organization of several B-specific proteins suggests that they are involved in negatively regulating Brr2, positioning the U6/5'ss helix, and stabilizing the B complex structure. Our results indicate significant differences between the early activation phase of human and yeast spliceosomes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3768.map.gz emd_3768.map.gz | 284.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3768-v30.xml emd-3768-v30.xml emd-3768.xml emd-3768.xml | 17 KB 17 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_3768.png emd_3768.png | 54.2 KB | ||
| その他 |  emd_3768_additional.map.gz emd_3768_additional.map.gz | 59.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3768 http://ftp.pdbj.org/pub/emdb/structures/EMD-3768 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3768 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3768 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_3768_validation.pdf.gz emd_3768_validation.pdf.gz | 253.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_3768_full_validation.pdf.gz emd_3768_full_validation.pdf.gz | 252.8 KB | 表示 | |
| XML形式データ |  emd_3768_validation.xml.gz emd_3768_validation.xml.gz | 7.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3768 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3768 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3768 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3768 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3768.map.gz / 形式: CCP4 / 大きさ: 307.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3768.map.gz / 形式: CCP4 / 大きさ: 307.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | sharpened, unmasked refinement. Map was aligned to high resolution map (EMDB 3766) and RESAMPLED from 256 px boxsize to 432 px boxsize in Chimera to fit high-resolution map. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.16 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
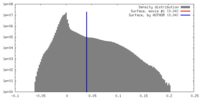
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: sharpened, unmasked refinement. Original, not resampled map
| ファイル | emd_3768_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | sharpened, unmasked refinement. Original, not resampled map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
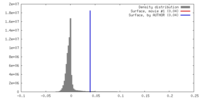
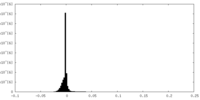
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Cryo-EM structure of a pre-catalytic human spliceosome primed for...
| 全体 | 名称: Cryo-EM structure of a pre-catalytic human spliceosome primed for activation (B complex) |
|---|---|
| 要素 |
|
-超分子 #1: Cryo-EM structure of a pre-catalytic human spliceosome primed for...
| 超分子 | 名称: Cryo-EM structure of a pre-catalytic human spliceosome primed for activation (B complex) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#43 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.9 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 80 % / チャンバー内温度: 277 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / デジタル化 - サンプリング間隔: 14.0 µm / デジタル化 - 画像ごとのフレーム数: 2-17 / 平均露光時間: 0.05 sec. / 平均電子線量: 1.5 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / Cs: 0.01 mm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL |
|---|
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)