+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of African swine fever virus topoisomerase II in complex with dsDNA | |||||||||
 マップデータ マップデータ | MAP | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | topo 2 / VIRAL PROTEIN-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報sister chromatid segregation / DNA topoisomerase type II (double strand cut, ATP-hydrolyzing) activity / DNA topoisomerase (ATP-hydrolysing) / DNA topological change / DNA binding / ATP binding / metal ion binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   African swine fever virus (アフリカ豚コレラウイルス) / DNA molecule (その他) African swine fever virus (アフリカ豚コレラウイルス) / DNA molecule (その他) | |||||||||
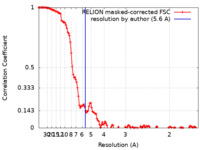
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.6 Å | |||||||||
 データ登録者 データ登録者 | Cong J / Xin Y / Li X / Chen Y | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structural insights into the DNA topoisomerase II of the African swine fever virus. 著者: Jingyuan Cong / Yuhui Xin / Huiling Kang / Yunge Yang / Chenlong Wang / Dongming Zhao / Xuemei Li / Zihe Rao / Yutao Chen /  要旨: Type II topoisomerases are ubiquitous enzymes that play a pivotal role in modulating the topological configuration of double-stranded DNA. These topoisomerases are required for DNA metabolism and ...Type II topoisomerases are ubiquitous enzymes that play a pivotal role in modulating the topological configuration of double-stranded DNA. These topoisomerases are required for DNA metabolism and have been extensively studied in both prokaryotic and eukaryotic organisms. However, our understanding of virus-encoded type II topoisomerases remains limited. One intriguing example is the African swine fever virus, which stands as the sole mammalian-infecting virus encoding a type II topoisomerase. In this work, we use several approaches including cryo-EM, X-ray crystallography, and biochemical assays to investigate the structure and function of the African swine fever virus type II topoisomerase, pP1192R. We determine the structures of pP1192R in different conformational states and confirm its enzymatic activity in vitro. Collectively, our results illustrate the basic mechanisms of viral type II topoisomerases, increasing our understanding of these enzymes and presenting a potential avenue for intervention strategies to mitigate the impact of the African swine fever virus. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37230.map.gz emd_37230.map.gz | 161.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37230-v30.xml emd-37230-v30.xml emd-37230.xml emd-37230.xml | 15.7 KB 15.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_37230_fsc.xml emd_37230_fsc.xml | 12.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_37230.png emd_37230.png | 26.7 KB | ||
| Filedesc metadata |  emd-37230.cif.gz emd-37230.cif.gz | 6.1 KB | ||
| その他 |  emd_37230_half_map_1.map.gz emd_37230_half_map_1.map.gz emd_37230_half_map_2.map.gz emd_37230_half_map_2.map.gz | 140.9 MB 140.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37230 http://ftp.pdbj.org/pub/emdb/structures/EMD-37230 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37230 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37230 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_37230_validation.pdf.gz emd_37230_validation.pdf.gz | 901.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_37230_full_validation.pdf.gz emd_37230_full_validation.pdf.gz | 901.5 KB | 表示 | |
| XML形式データ |  emd_37230_validation.xml.gz emd_37230_validation.xml.gz | 20 KB | 表示 | |
| CIF形式データ |  emd_37230_validation.cif.gz emd_37230_validation.cif.gz | 26.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37230 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37230 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37230 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37230 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8kgqMC  8kglC  8kgmC  8kgnC  8kgoC  8kgpC  8kgrC  8kgsC  8kgtC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37230.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37230.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | MAP | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.82 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: HALFMAP
| ファイル | emd_37230_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | HALFMAP | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: HALFMAP
| ファイル | emd_37230_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | HALFMAP | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : pP1192R
| 全体 | 名称: pP1192R |
|---|---|
| 要素 |
|
-超分子 #1: pP1192R
| 超分子 | 名称: pP1192R / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 / 詳細: dimer |
|---|---|
| 由来(天然) | 生物種:   African swine fever virus (アフリカ豚コレラウイルス) African swine fever virus (アフリカ豚コレラウイルス) |
-分子 #1: DNA (38-MER)
| 分子 | 名称: DNA (38-MER) / タイプ: dna / ID: 1 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: DNA molecule (その他) |
| 分子量 | 理論値: 16.058391 KDa |
| 配列 | 文字列: (DA)(DT)(DG)(DC)(DA)(DT)(DA)(DT)(DA)(DT) (DA)(DT)(DG)(DT)(DA)(DT)(DA)(DT)(DG)(DT) (DA)(DT)(DG)(DT)(DG)(DT)(DG)(DT)(DA) (DT)(DA)(DT)(DA)(DT)(DA)(DC)(DA)(DC)(DA) (DT) (DA)(DT)(DA)(DT)(DA) ...文字列: (DA)(DT)(DG)(DC)(DA)(DT)(DA)(DT)(DA)(DT) (DA)(DT)(DG)(DT)(DA)(DT)(DA)(DT)(DG)(DT) (DA)(DT)(DG)(DT)(DG)(DT)(DG)(DT)(DA) (DT)(DA)(DT)(DA)(DT)(DA)(DC)(DA)(DC)(DA) (DT) (DA)(DT)(DA)(DT)(DA)(DT)(DA)(DT) (DA)(DT)(DA)(DT) |
-分子 #2: DNA (38-MER)
| 分子 | 名称: DNA (38-MER) / タイプ: dna / ID: 2 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: DNA molecule (その他) |
| 分子量 | 理論値: 15.965361 KDa |
| 配列 | 文字列: (DA)(DT)(DA)(DT)(DA)(DT)(DA)(DT)(DA)(DT) (DA)(DT)(DA)(DT)(DG)(DT)(DG)(DT)(DA)(DT) (DA)(DT)(DA)(DT)(DA)(DC)(DA)(DC)(DA) (DC)(DA)(DT)(DA)(DC)(DA)(DT)(DA)(DT)(DA) (DC) (DA)(DT)(DA)(DT)(DA) ...文字列: (DA)(DT)(DA)(DT)(DA)(DT)(DA)(DT)(DA)(DT) (DA)(DT)(DA)(DT)(DG)(DT)(DG)(DT)(DA)(DT) (DA)(DT)(DA)(DT)(DA)(DC)(DA)(DC)(DA) (DC)(DA)(DT)(DA)(DC)(DA)(DT)(DA)(DT)(DA) (DC) (DA)(DT)(DA)(DT)(DA)(DT)(DA)(DT) (DG)(DC)(DA)(DT) |
-分子 #3: DNA topoisomerase 2
| 分子 | 名称: DNA topoisomerase 2 / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   African swine fever virus (アフリカ豚コレラウイルス) African swine fever virus (アフリカ豚コレラウイルス) |
| 分子量 | 理論値: 138.093359 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: EFATMEAFEI SDFKEHAKKK SMWAGALNKV TISGLMGVFT EDEDLMALPI HRDHCPALLK IFDEIIVNAT DHERACHNKT KKVTYIKIS FDKGVFSCEN DGPGIPIAKH EQASLIAKRD VYVPEVASCH FLAGTNINKA KDCIKGGTNG VGLKLAMVHS Q WAILTTAD ...文字列: EFATMEAFEI SDFKEHAKKK SMWAGALNKV TISGLMGVFT EDEDLMALPI HRDHCPALLK IFDEIIVNAT DHERACHNKT KKVTYIKIS FDKGVFSCEN DGPGIPIAKH EQASLIAKRD VYVPEVASCH FLAGTNINKA KDCIKGGTNG VGLKLAMVHS Q WAILTTAD GAQKYVQHIN QRLDIIEPPT ITPSREMFTR IELMPVYQEL GYAEPLSETE QADLSAWIYL RACQCAAYVG KG TTIYYND KPCRTGSVMA LAKMYTLLSA PNSTIHTATI KADAKPYSLH PLQVAAVVSP KFKKFEHVSV INGVNCVKGE HVT FLKKTI NEMVVKKFQQ TIKDKNRKTT LRDSCSNIFI VIVGSIPGIE WTGQRKDELS IAENVFKTHY SIPSSFLTSM TKSI VDILL QSISKKDNHK QVDVDKYTRA RNAGGKRAQD CMLLAAEGDS ALSLLRTGLT LGKSNPSGPS FDFCGMISLG GVIMN ACKK VTNITTDSGE TIMVRNEQLT NNKVLQGIVQ VLGLDFNCHY KTQEERAKLR YGCIVACVDQ DLDGCGKILG LLLAYF HLF WPQLIIHGFV KRLLTPLIRV YEKGKTMPVE FYYEQEFDAW AKKQTSLANH TVKYYKGLAA HDTHEVKSMF KHFDNMV YT FTLDDSAKEL FHIYFGGESE LRKRELCTGV VPLTETQTQS IHSVRRIPCS LHLQVDTKAY KLDAIERQIP NFLDGMTR A RRKILAGGVK CFASNNRERK VFQFGGYVAD HMFYHHGDMS LNTSIIKAAQ YYPGSSHLYP VFIGIGSFGS RHLGGKDAG SPRYISVQLA SEFIKTMFPA EDSWLLPYVF EDGQRAEPEY YVPVLPLAIM EYGANPSEGW KYTTWARQLE DILALVRAYV DKDNPKHEL LHYAIKHKIT ILPLRPSNYN FKGHLKRFGQ YYYSYGTYVI SEQRNIITIT ELPLRVPTVA YIESIKKSSN R MTFIEEII DYSSSETIEI LVKLKPNSLN RIVEEFKETE EQDSIENFLR LRNCLHSHLN FVKPKGGIIE FNTYYEILYA WL PYRRELY QKRLMREHAV LKLRIIMETA IVRYINESAE LNLSHYEDEK EASRILSEHG FPPLNHTLII SPEFASIEEL NQK ALQGCY TYILSLQARE LLIAAKTRRV EKIKKMQARL DKVEQLLQES PFPGASVWLE EIDAVEKAII KGRNTQWKFH ENLY FQGHH HHHHHH UniProtKB: DNA topoisomerase 2 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.2 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.2 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)