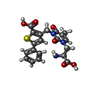
| 登録情報 | データベース: PDB / ID: 2qs3
|
|---|
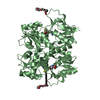
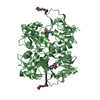
| タイトル | Crystal structure of the GluR5 ligand binding core dimer in complex with UBP316 at 1.76 Angstroms resolution |
|---|
 要素 要素 | Glutamate receptor, ionotropic kainate 1 |
|---|
 キーワード キーワード | MEMBRANE PROTEIN / Cell junction / Glycoprotein / Ion transport / Ionic channel / Phosphorylation / Postsynaptic cell membrane / Receptor / RNA editing / Synapse / Transmembrane / Transport |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of synaptic transmission, GABAergic / gamma-aminobutyric acid secretion / L-glutamate transmembrane transporter activity / positive regulation of gamma-aminobutyric acid secretion / Activation of Na-permeable kainate receptors / kainate selective glutamate receptor complex / Activation of Ca-permeable Kainate Receptor / regulation of short-term neuronal synaptic plasticity / negative regulation of synaptic transmission, glutamatergic / glutamate binding ...negative regulation of synaptic transmission, GABAergic / gamma-aminobutyric acid secretion / L-glutamate transmembrane transporter activity / positive regulation of gamma-aminobutyric acid secretion / Activation of Na-permeable kainate receptors / kainate selective glutamate receptor complex / Activation of Ca-permeable Kainate Receptor / regulation of short-term neuronal synaptic plasticity / negative regulation of synaptic transmission, glutamatergic / glutamate binding / inhibitory postsynaptic potential / synaptic transmission, GABAergic / adult behavior / behavioral response to pain / modulation of excitatory postsynaptic potential / kainate selective glutamate receptor activity / extracellularly glutamate-gated ion channel activity / ionotropic glutamate receptor complex / membrane depolarization / glutamate-gated receptor activity / glutamate-gated calcium ion channel activity / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / presynaptic modulation of chemical synaptic transmission / ionotropic glutamate receptor signaling pathway / SNARE binding / excitatory postsynaptic potential / regulation of membrane potential / positive regulation of synaptic transmission, GABAergic / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / synaptic transmission, glutamatergic / establishment of localization in cell / postsynaptic density membrane / modulation of chemical synaptic transmission / regulation of synaptic plasticity / terminal bouton / nervous system development / presynaptic membrane / scaffold protein binding / chemical synaptic transmission / postsynaptic membrane / receptor complex / postsynaptic density / neuronal cell body / synapse / dendrite / glutamatergic synapse / identical protein binding / membrane / plasma membrane類似検索 - 分子機能 Ionotropic glutamate receptor, metazoa / Ligated ion channel L-glutamate- and glycine-binding site / Ionotropic glutamate receptor, L-glutamate and glycine-binding domain / Ligated ion channel L-glutamate- and glycine-binding site / Ligand-gated ion channel / : / Ionotropic glutamate receptor / Eukaryotic homologues of bacterial periplasmic substrate binding proteins. / Receptor, ligand binding region / Receptor family ligand binding region ...Ionotropic glutamate receptor, metazoa / Ligated ion channel L-glutamate- and glycine-binding site / Ionotropic glutamate receptor, L-glutamate and glycine-binding domain / Ligated ion channel L-glutamate- and glycine-binding site / Ligand-gated ion channel / : / Ionotropic glutamate receptor / Eukaryotic homologues of bacterial periplasmic substrate binding proteins. / Receptor, ligand binding region / Receptor family ligand binding region / Periplasmic binding protein-like II / Periplasmic binding protein-like I / D-Maltodextrin-Binding Protein; domain 2 / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 Chem-UBE / Glutamate receptor ionotropic, kainate 1類似検索 - 構成要素 |
|---|
| 生物種 |   Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 1.76 Å フーリエ合成 / 解像度: 1.76 Å |
|---|
 データ登録者 データ登録者 | Alushin, G.M. / Jane, D.E. / Mayer, M.L. |
|---|
 引用 引用 |  ジャーナル: Neuropharmacology / 年: 2009 ジャーナル: Neuropharmacology / 年: 2009
タイトル: ACET is a highly potent and specific kainate receptor antagonist: characterisation and effects on hippocampal mossy fibre function.
著者: Dargan, S.L. / Clarke, V.R. / Alushin, G.M. / Sherwood, J.L. / Nistico, R. / Bortolotto, Z.A. / Ogden, A.M. / Bleakman, D. / Doherty, A.J. / Lodge, D. / Mayer, M.L. / Fitzjohn, S.M. / Jane, D. ...著者: Dargan, S.L. / Clarke, V.R. / Alushin, G.M. / Sherwood, J.L. / Nistico, R. / Bortolotto, Z.A. / Ogden, A.M. / Bleakman, D. / Doherty, A.J. / Lodge, D. / Mayer, M.L. / Fitzjohn, S.M. / Jane, D.E. / Collingridge, G.L. |
|---|
| 履歴 | | 登録 | 2007年7月30日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2008年8月5日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Advisory / Version format compliance |
|---|
| 改定 1.2 | 2012年8月22日 | Group: Database references |
|---|
| 改定 1.3 | 2017年8月2日 | Group: Source and taxonomy / カテゴリ: entity_src_gen |
|---|
| 改定 1.4 | 2021年10月20日 | Group: Database references / Derived calculations / カテゴリ: database_2 / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.5 | 2023年8月30日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  フーリエ合成 / 解像度: 1.76 Å
フーリエ合成 / 解像度: 1.76 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Neuropharmacology / 年: 2009
ジャーナル: Neuropharmacology / 年: 2009 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2qs3.cif.gz
2qs3.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2qs3.ent.gz
pdb2qs3.ent.gz PDB形式
PDB形式 2qs3.json.gz
2qs3.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2qs3_validation.pdf.gz
2qs3_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2qs3_full_validation.pdf.gz
2qs3_full_validation.pdf.gz 2qs3_validation.xml.gz
2qs3_validation.xml.gz 2qs3_validation.cif.gz
2qs3_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/qs/2qs3
https://data.pdbj.org/pub/pdb/validation_reports/qs/2qs3 ftp://data.pdbj.org/pub/pdb/validation_reports/qs/2qs3
ftp://data.pdbj.org/pub/pdb/validation_reports/qs/2qs3
 リンク
リンク 集合体
集合体


 要素
要素

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-ID / 波長: 1 Å
/ ビームライン: 22-ID / 波長: 1 Å 解析
解析 フーリエ合成
フーリエ合成 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj